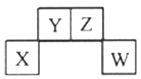
ћвƒњƒЏ»Ё
°Њћвƒњ°њћъ°Ґ¬Ѕ°ҐЌ≠µ»љр фЉ∞∆дїѓЇѕќп‘Џ»’≥£…ъїо÷–”¶”√єгЈЇ£ђ«лЄщЊЁѕ¬Ѕ– µ—йїЎірќ ћв:
(1)…ъћъ÷–Їђ”–“ї÷÷ћъћЉїѓЇѕќпX(Fe3C)°£X‘Џ„гЅњµƒњ’∆ш÷–Єяќ¬м—…’£ђ…ъ≥…”–і≈–‘µƒєћћеY£ђљЂY»№”ЏєэЅњ—ќЋбµƒ»№“Ї÷–Їђ”–µƒіуЅњ—фјл„” «___°£
(2)ƒ≥»№“Ї÷–”–Mg2+°ҐFe2+°ҐAl3+°ҐCu2+µ»Ћƒ÷÷јл„”£ђѕт∆д÷–Љ”»лєэЅњµƒNaOH»№“ЇЇу£ђєэ¬Ћ£ђљЂ¬Ћ‘ьЄяќ¬„∆…’≤ҐљЂ„∆…’ЇуµƒєћћеЌґ»лєэЅњµƒѕ°—ќЋб÷–£ђЋщµ√»№“Ї”л‘≠»№“Їѕа±»£ђ»№“Ї÷–іуЅњЉх…ўµƒ—фјл„” «______________°£
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
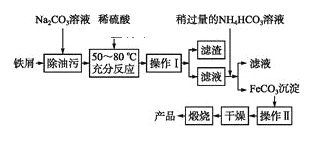
(3)—хїѓћъ «÷Ў“™є§“µ—’Ѕѕ£ђ”√Јѕћъ–Љ÷∆±ЄЋьµƒЅч≥ћ»зѕ¬£Ї
їЎірѕ¬Ѕ–ќ ћв:
Ґў≤ў„чҐсµƒ√ы≥∆ «____£ђ≤ў„чҐтµƒ√ы≥∆ «____°£ҐЏ–і≥ц‘Џњ’∆ш÷–м—…’FeCO3µƒїѓ—ІЈљ≥ћ љ________________°£
(4)”––©Ќђ—І»ѕќ™KMnO4»№“Їµќґ®“≤ƒ№љш––ћъ‘™ЋЎЇђЅњµƒ≤вґ®°£
a.≥∆»°2.850 g¬ћЈѓ(FeSO4°§7H2O)≤ъ∆Ј£ђ»№љв£ђ‘Џ250 mL»ЁЅњ∆њ÷–ґ®»Ё£ї
b.Ѕњ»°25.00 mLіэ≤в»№“ЇЈ≈»л„ґ–ќ∆њ÷–£ї
c.”√ЅтЋбЋбїѓµƒ0.01000 mol°§L-1KMnO4»№“Їµќґ®÷Ѕ÷’µг£ђѕыЇƒKMnO4»№“Їћеїэµƒ∆љЊщ÷µќ™20.00 mL°£
Ґўіпµљµќґ®÷’µг ±µƒѕ÷ѕу____°£
ҐЏƒ≥Ќђ—І…иЉ∆µƒѕ¬Ѕ–µќґ®Јљ љ,„оЇѕјнµƒ «____°£(Љ–≥÷≤њЈ÷¬‘»•)(ћо„÷ƒЄ–тЇ≈)
ҐџЉ∆Ћг…ѕ ц—щ∆Ј÷–FeSO4°§7H2Oµƒ÷ ЅњЈ÷ эќ™____°£
°Њір∞Є°њFe2+°ҐFe3+°ҐH+ BC єэ¬Ћ ѕіµ” 4FeCO3+ O2![]() 2Fe2O3+4CO2 µ±µќ»л„оЇу“їµќЄя√ћЋбЉЎ»№“Ї£ђ»№“Ї”…«≥¬ћ…Ђ±д≥…ЈџЇм…Ђ£ђ«“∞лЈ÷÷”ƒЏ—’…Ђ≤ї‘ўЄƒ±д b 97.5%
2Fe2O3+4CO2 µ±µќ»л„оЇу“їµќЄя√ћЋбЉЎ»№“Ї£ђ»№“Ї”…«≥¬ћ…Ђ±д≥…ЈџЇм…Ђ£ђ«“∞лЈ÷÷”ƒЏ—’…Ђ≤ї‘ўЄƒ±д b 97.5%
°Њљвќц°њ
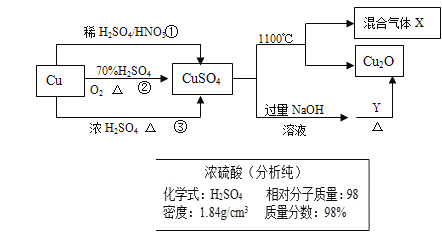
(1)X‘Џ„гЅњµƒњ’∆ш÷–Єяќ¬м—…’£ђ…ъ≥…”–і≈–‘µƒєћћеY£ђYќ™Ћƒ—хїѓ»эћъ£ђ”л—ќЋбЈі”¶…ъ≥…¬»їѓћъ°Ґ¬»їѓ—«ћъ£ђY»№”ЏєэЅњ—ќЋбЇу»№“Ї÷–іуЅњіж‘Џµƒ—фјл„” «Fe2+°ҐFe3+°ҐH+
є ір∞Єќ™£ЇFe2+°ҐFe3+°ҐH+£ї
(2)Љ”»лєэЅњµƒNaOH»№“ЇЇу£ђMg2+°ҐFe2+°ҐCu2+„™їѓќ™≥Ѕµн£ђ¬Ѕ”л«в—хїѓƒ∆Јі”¶„о÷’…ъ≥…∆Ђ¬ЅЋбƒ∆Ѕф‘Џ¬Ћ“Ї÷–£ђ„∆…’љЂ—«ћъ„™їѓќ™»эЉџћъ£ђ„∆…’ЇуµƒєћћеЌґ»лєэЅњµƒѕ°—ќЋб£ђ»№“Ї÷–іж‘ЏMg2+°ҐFe3+°ҐCu2+£ђ‘тЋщµ√»№“Ї”л‘≠»№“Їѕа±»£ђ»№“Ї÷–іуЅњЉх…ўµƒ—фјл„” «Fe2+°ҐAl3+£ђє ір∞Єќ™£ЇBC£ї
(3)”…÷∆±ЄЅч≥ћњ…÷™£ђћЉЋбƒ∆ЋЃљвѕ‘Љо–‘£ђњ…іўљш”ЌќџµƒЋЃљв£ђЉ”ѕ°ЅтЋб≥э»•ћЉЋбƒ∆£ђ«“»№љвFe£ђ≤ў„чIќ™єэ¬Ћ£ђ¬Ћ“Ї÷–ЇђFe2+£ђ”лћЉЋб«впІЈі”¶…ъ≥…ћЉЋб—«ћъ≥Ѕµн£ђ≤ў„чIIќ™ѕіµ”£ђ»їЇуЄ…‘п°Ґ„∆…’µ√µљ—хїѓћъ°£
Ґў”…є§“’Ѕч≥ћњ…÷™£ђ≤ў„чI «љЂєћће”л“ЇћеЈ÷јл£ђ”¶≤…»°єэ¬ЋµƒЈљЈ®£їFeCO3≥ЅµнїбЄљ„≈∆дЋьјл„”£ђ–и“™љш––ѕіµ”£ђЉх…ў‘”÷ £ђ
є ір∞Єќ™£Їєэ¬Ћ£їѕіµ”£ї
ҐЏ‘Џњ’∆ш÷–м—…’FeCO3£ђ—х∆шљЂ—«ћъ—хїѓќ™»эЉџћъ£ђїѓ—ІЈљ≥ћ љќ™£Ї4FeCO3+ O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
є ір∞Єќ™£Ї4FeCO3+ O2![]() 2Fe2O3+4CO2£ї
2Fe2O3+4CO2£ї
(4) Ґў”√—хїѓ–‘µƒЋб–‘Єя√ћЋбЉЎ£®„ѕЇм…Ђ£©µќґ®Њя”–їє‘≠–‘µƒЅтЋб—«ћъ£®«≥¬ћ…Ђ£©£ђЈҐ…ъ—хїѓїє‘≠Јі”¶£ђ—«ћъјл„”„™±дќ™»эЉџћъјл„”іпµљµќґ®÷’µг ±µƒѕ÷ѕу£Їµ±µќ»л„оЇу“їµќЄя√ћЋбЉЎ»№“Ї£ђ»№“Ї”…«≥¬ћ…Ђ±д≥…ЈџЇм…Ђ£ђ«“∞лЈ÷÷”ƒЏ—’…Ђ≤ї‘ўЄƒ±д°£
ір∞Єќ™£Їµ±µќ»л„оЇу“їµќЄя√ћЋбЉЎ»№“Ї£ђ»№“Ї”…«≥¬ћ…Ђ±д≥…ЈџЇм…Ђ£ђ«“∞лЈ÷÷”ƒЏ—’…Ђ≤ї‘ўЄƒ±д°£
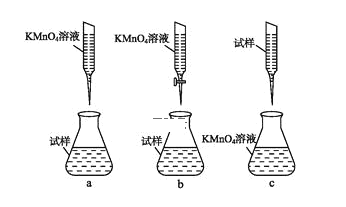
ҐЏЋб–‘»№“Їїт«њ—хїѓ–‘»№“Ї”¶”√Ћб љµќґ®є№£ђ
є ір∞Єќ™£Їb
Ґџn£®MnO4-£©=0.01000mol/L°Ѕ0.02L=2°Ѕ10-4mol£ђ‘т”…5Fe2++MnO4-+8H+®T5Fe3++Mn2++4H2Oњ…÷™n£®Fe2+£©=5°Ѕ2°Ѕ10-4mol=1°Ѕ10-3mol£ђ
Ћщ“‘250mL»№“Ї÷–Їђ”–÷™n£®Fe2+£©=1°Ѕ10-2mol£ђ
‘тm£®FeSO47H2O£©=278g/mol°Ѕ1°Ѕ10-2mol=2.780 g£ђ
—щ∆Ј÷–FeSO47H2Oµƒ÷ ЅњЈ÷ эќ™![]() °Ѕ100%=97.5%£ї
°Ѕ100%=97.5%£ї
є ір∞Єќ™£Ї97.5%°£

°Њћвƒњ°њ£®“ї£©ѕ÷”–≈®ґ»Њщќ™![]() µƒ—ќЋб°ҐЅтЋб°Ґі„Ћб»э÷÷»№“Ї,їЎірѕ¬Ѕ–ќ ћв£Ї
µƒ—ќЋб°ҐЅтЋб°Ґі„Ћб»э÷÷»№“Ї,їЎірѕ¬Ѕ–ќ ћв£Ї
£®1£©»ф»э÷÷»№“Ї÷–![]() Ј÷±рќ™
Ј÷±рќ™![]() ,‘тЋь√«µƒіу–°єЎѕµќ™_________________________________________°£
,‘тЋь√«µƒіу–°єЎѕµќ™_________________________________________°£
£®2£©µ»ћеїэµƒ“‘…ѕ»э÷÷ЋбЈ÷±р”лєэЅњµƒ![]() »№“ЇЈі”¶,»ф…ъ≥…µƒ—ќµƒќп÷ µƒЅњ“јіќќ™
»№“ЇЈі”¶,»ф…ъ≥…µƒ—ќµƒќп÷ µƒЅњ“јіќќ™![]() £ђ‘тЋь√«µƒіу–°єЎѕµќ™__________________________°£
£ђ‘тЋь√«µƒіу–°єЎѕµќ™__________________________°£
£®3£©Ј÷±р”√“‘…ѕ»э÷÷Ћб÷–ЇЌ“їґ®Ѕњµƒ![]() »№“Ї…ъ≥…’э—ќ,»ф–и“™ЋбµƒћеїэЈ÷±рќ™
»№“Ї…ъ≥…’э—ќ,»ф–и“™ЋбµƒћеїэЈ÷±рќ™![]() £ђ∆діу–°єЎѕµќ™__________________________________°£
£ђ∆діу–°єЎѕµќ™__________________________________°£
£®4£©Ј÷±р”л–њЈі”¶,њ™ Љ ±…ъ≥…«в∆шµƒЋў¬ ќ™![]() £ђ∆діу–°єЎѕµќ™______________________°£
£ђ∆діу–°єЎѕµќ™______________________°£
£®ґю£©”–![]() Ћƒ÷÷«њµзљв÷ ,Ћь√«‘ЏЋЃ÷–µзјл≤ъ…ъѕ¬Ѕ–јл„”£®√њ÷÷ќп÷ ÷їЇђ“ї÷÷“хјл„”«“ї•≤ї÷ЎЄі£©°£
Ћƒ÷÷«њµзљв÷ ,Ћь√«‘ЏЋЃ÷–µзјл≤ъ…ъѕ¬Ѕ–јл„”£®√њ÷÷ќп÷ ÷їЇђ“ї÷÷“хјл„”«“ї•≤ї÷ЎЄі£©°£
—фјл„” |
|
“хјл„” |
|
“—÷™:Ґў![]() »№“Їµƒ
»№“Їµƒ![]() Њщіу”Џ7,
Њщіу”Џ7, ![]() µƒ»№“Ї÷–ЋЃµƒµзјл≥ћґ»ѕаЌђ£їҐЏ
µƒ»№“Ї÷–ЋЃµƒµзјл≥ћґ»ѕаЌђ£їҐЏ![]() »№“ЇЇЌ
»№“ЇЇЌ![]() »№“Їѕа”ц ±÷ї…ъ≥…∞„…Ђ≥Ѕµн,
»№“Їѕа”ц ±÷ї…ъ≥…∞„…Ђ≥Ѕµн, ![]() »№“ЇЇЌ
»№“ЇЇЌ![]() »№“Їѕа”ц ±÷ї…ъ≥…іћЉ§–‘∆шќґµƒ∆шће,
»№“Їѕа”ц ±÷ї…ъ≥…іћЉ§–‘∆шќґµƒ∆шће, ![]() »№“ЇЇЌ
»№“ЇЇЌ![]() »№“ЇїмЇѕ ±ќёѕ÷ѕу°£
»№“ЇїмЇѕ ±ќёѕ÷ѕу°£
£®1£© ![]() «_________________________£ђ
«_________________________£ђ![]() «_______________________£®ћоїѓ—І љ£©°£
«_______________________£®ћоїѓ—І љ£©°£
£®2£©–і≥ц![]() ЇЌ
ЇЌ![]() Јі”¶µƒјл„”Јљ≥ћ љ_________________________________°£
Јі”¶µƒјл„”Јљ≥ћ љ_________________________________°£
£®3£© ![]() ±,
±, ![]() »№“Їµƒ
»№“Їµƒ![]() ,‘т
,‘т![]() »№“Ї÷–
»№“Ї÷–![]() _________________________________________£®”√Їђ”–
_________________________________________£®”√Їђ”–![]() µƒєЎѕµ љ±н Њ£©°£
µƒєЎѕµ љ±н Њ£©°£
£®4£©љЂµ»ћеїэ°Ґµ»ќп÷ µƒЅњ≈®ґ»µƒ![]() »№“ЇЇЌ
»№“ЇЇЌ![]() »№“ЇїмЇѕ,Јі”¶Їу»№“Ї÷–Єч÷÷јл„”≈®ґ»”…іуµљ–°µƒЋ≥–т «_________________________°£
»№“ЇїмЇѕ,Јі”¶Їу»№“Ї÷–Єч÷÷јл„”≈®ґ»”…іуµљ–°µƒЋ≥–т «_________________________°£
£®5£©‘Џ“їґ®ћеїэµƒ![]() µƒ
µƒ![]() »№“Ї÷–,Љ”»л“їґ®ћеїэµƒ
»№“Ї÷–,Љ”»л“їґ®ћеїэµƒ![]() µƒ—ќЋб,їмЇѕ»№“Їµƒ
µƒ—ќЋб,їмЇѕ»№“Їµƒ![]() ,»фЈі”¶Їу»№“Їµƒћеїэµ»”Џ
,»фЈі”¶Їу»№“Їµƒћеїэµ»”Џ![]() »№“Ї”л—ќЋбµƒћеїэ÷ЃЇЌ,‘т
»№“Ї”л—ќЋбµƒћеїэ÷ЃЇЌ,‘т![]() »№“Ї”л—ќЋбµƒћеїэ±» «_______________°£
»№“Ї”л—ќЋбµƒћеїэ±» «_______________°£
°Њћвƒњ°њє§“µ…ѕјы”√N2ЇЌH2њ…“‘ µѕ÷Їѕ≥…∞±∆ш£ђґш∞±”÷њ…“‘љш“ї≤љ÷∆±ЄѕхЋб£ђ‘Џє§“µ…ѕ“ї∞гњ…љш––Ѕђ–ш…ъ≤ъ°£«лїЎірѕ¬Ѕ–”–єЎќ ћв£Ї
£®1£©“—÷™N2(g)+O2(g)=2NO(g) ¶§H =+180.5kJ°§mol£≠1£ђN2(g)+3H2(g)![]() 2NH3(g) ¶§H =£≠92.4kJ°§mol£≠1£ђ2H2(g)+O2(g)=2H2O(g) ¶§H =£≠483.6kJ°§mol£≠1£ђ–і≥ц∞±∆шЊ≠іяїѓ—хїѓЌк»Ђ…ъ≥…“ї—хїѓµ™ЇЌЋЃ’ф∆шµƒ»»їѓ—ІЈљ≥ћ љќ™___________°£
2NH3(g) ¶§H =£≠92.4kJ°§mol£≠1£ђ2H2(g)+O2(g)=2H2O(g) ¶§H =£≠483.6kJ°§mol£≠1£ђ–і≥ц∞±∆шЊ≠іяїѓ—хїѓЌк»Ђ…ъ≥…“ї—хїѓµ™ЇЌЋЃ’ф∆шµƒ»»їѓ—ІЈљ≥ћ љќ™___________°£
£®2£©‘Џ“їґ®ћеїэµƒ√№±’»Ё∆ч÷–£ђљш––»зѕ¬їѓ—ІЈі”¶£ЇN2(g)+3H2(g)![]() 2NH3(g)£ђ∆дїѓ—І∆љЇв≥£ эK”лќ¬ґ»tµƒєЎѕµ»зѕ¬±н£Ї
2NH3(g)£ђ∆дїѓ—І∆љЇв≥£ эK”лќ¬ґ»tµƒєЎѕµ»зѕ¬±н£Ї
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1°Ѕ106 | K1 | K2 | ...... |
Ќк≥…ѕ¬Ѕ–ќ ћв£Ї
Ґў±»љѕK1°ҐK2µƒіу–°£ЇK1______K2(ћо°∞>°±°Ґ°∞=°±їт°∞<°±)£ї
ҐЏ‘ЏЇгќ¬Їг—єѕ¬≈–ґѕЄ√Јі”¶іпµљїѓ—І∆љЇв„іћђµƒ“јЊЁ «______(ћо–тЇ≈)£ї
A£Ѓ2v(H2)(’э)=3v(NH3)(ƒж) B£Ѓ2v(N2) (’э)=v(H2) (ƒж)
C£Ѓ»Ё∆чƒЏ—є«њ±£≥÷≤ї±д D£ЃїмЇѕ∆шћеµƒ√№ґ»±£≥÷≤ї±д
£®3£©ѕхЋбє§“µµƒќ≤∆шNOњ…”√”Џ÷∆±ЄNH4NO3£ђ∆дє§„ч‘≠јн»зЌЉ°£
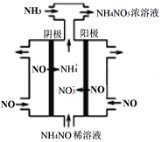
Ґў∆д“хЉЂµƒµзЉЂЈі”¶ љќ™___________°£
ҐЏ≥£ќ¬ѕ¬£ђ1L pH=6µƒNH4NO3»№“Ї÷–c(NH3°§H2O)+c(OH£≠)=________mol°§L£≠1°£
£®4£©є§“µ…ѕ…ъ≤ъƒтЋЎµƒїѓ—ІЈљ≥ћ љќ™£Ї2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)°£‘ЏT°ж£ђћеїэќ™4Lµƒ√№±’»Ё∆ч÷–£ђЌ®»л6mol NH3ЇЌ3mol CO2£ђЈі”¶іпµљ∆љЇв ±£ђc(NH3)=0.5mol°§L£≠1£ђc(CO2)=0.25mol°§L£≠1°£»фіЋ ±±£≥÷T°жЇЌ∆љЇв ±»Ё∆чµƒ—є«њ≤ї±д£ђ‘ўѕтћеїэњ…±дµƒ»Ё∆ч÷–≥д»л3mol NH3£ђ‘тіЋ ±Јі”¶µƒv’э____ vƒж(ћо°∞>°±°∞<°±їт°∞=°±)°£‘ўіќ∆љЇвЇу£ђ∆љЇв≥£ эќ™______°£
CO(NH2)2(s)+H2O(l)°£‘ЏT°ж£ђћеїэќ™4Lµƒ√№±’»Ё∆ч÷–£ђЌ®»л6mol NH3ЇЌ3mol CO2£ђЈі”¶іпµљ∆љЇв ±£ђc(NH3)=0.5mol°§L£≠1£ђc(CO2)=0.25mol°§L£≠1°£»фіЋ ±±£≥÷T°жЇЌ∆љЇв ±»Ё∆чµƒ—є«њ≤ї±д£ђ‘ўѕтћеїэњ…±дµƒ»Ё∆ч÷–≥д»л3mol NH3£ђ‘тіЋ ±Јі”¶µƒv’э____ vƒж(ћо°∞>°±°∞<°±їт°∞=°±)°£‘ўіќ∆љЇвЇу£ђ∆љЇв≥£ эќ™______°£