题目内容
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
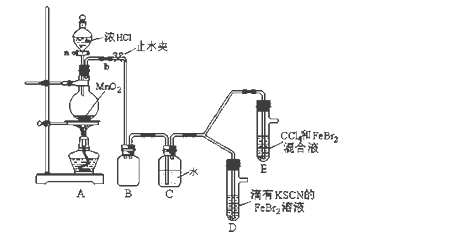
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 缺少尾气处理装置 Cl2 > Br2 > Fe3+ 过量氯气和SCN –反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则
Mn2++Cl2↑+2H2O 缺少尾气处理装置 Cl2 > Br2 > Fe3+ 过量氯气和SCN –反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则
Fe3++3SCN-![]() Fe(SCN)3 平衡逆向移动而褪色。 KSCN溶液 变红色(或FeCl3溶液,不变红) BrCl + H2O = HBrO + HCl Ag++Cl-=AgCl↓
Fe(SCN)3 平衡逆向移动而褪色。 KSCN溶液 变红色(或FeCl3溶液,不变红) BrCl + H2O = HBrO + HCl Ag++Cl-=AgCl↓
【解析】
(1)①在装置A中浓盐酸与MnO2在加热时发生反应产生氯气,发生反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;②氯气是有毒气体,会造成大气污染,在整套实验装置存在一处明显的不足,就是缺少尾气处理装置。
Mn2++Cl2↑+2H2O;②氯气是有毒气体,会造成大气污染,在整套实验装置存在一处明显的不足,就是缺少尾气处理装置。
(2)用改正后的装置进行实验,实验过程如下:打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯,会发现:D装置中:溶液变红,说明发生反应:Cl2+2Fe2+=2Cl-+2Fe3+,证明氧化性:Cl2>Fe3+,Fe3+于SCN-溶液变为红色;E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。证明发生反应:Cl2+2Br-=2Cl-+Br2,氧化性:Cl2>Br2;Br2+2Fe2+=2Br-+2Fe3+,证明氧化性:Br2>Fe3+,从而证明氧化性:Cl2>Br2>Fe3+;
(3)Fe3++3SCN-![]() Fe(SCN)3是一个可逆反应,当Cl2过量时,过量的氯气和SCN –反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-
Fe(SCN)3是一个可逆反应,当Cl2过量时,过量的氯气和SCN –反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-![]() Fe(SCN)3 平衡逆向移动而褪色。现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液,溶液,若溶液颜色变红色,就证明是平衡发生了移动;或向溶液中滴加FeCl3溶液,溶液不变红色,也证明溶液中SCN-浓度减小,平衡发生了移动;探究E中颜色变化的原因,用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。这是由于Cl2+Br2=2BrCl;BrCl + H2O =HBrO + HCl ,Ag++Cl-=AgCl↓,所以溶液颜色变成红色。
Fe(SCN)3 平衡逆向移动而褪色。现设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液,溶液,若溶液颜色变红色,就证明是平衡发生了移动;或向溶液中滴加FeCl3溶液,溶液不变红色,也证明溶液中SCN-浓度减小,平衡发生了移动;探究E中颜色变化的原因,用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。这是由于Cl2+Br2=2BrCl;BrCl + H2O =HBrO + HCl ,Ag++Cl-=AgCl↓,所以溶液颜色变成红色。

 名校课堂系列答案
名校课堂系列答案