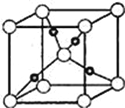
��Ŀ����
����Ŀ������ƿ��ǩ���Լ����ֱ�ʢ��AgNO3��Һ��ϡ���ᡢ���ᡢ�Ȼ�����Һ��̼�����Һ��Ϊ��ȷ����ƿ����ʲô�Լ���������������ΪA��B��C��D��E����С�Թܸ�ʢ������ν���������Ϸ�Ӧ����Ӧ����Ϊ��A��B��A��E���ɲ�����ɫ����������A��B��Ӧ�����������������ᣬA��E��Ӧ�����ɵİ�ɫ������������C��D��B��D��B��E����������E��C��E��D��Ӧ���ɲ���������̼���壻��C��D��������ͬһ�����ʣ����ʱ��Ӧ����
�ɴˣ����ж����Լ�ƿ����ʢ�Լ�Ϊ���û�ѧʽ��ʾ��
A________��B________��C________��D________��E________��
���⣬��д������Ҫ������ӷ���ʽ��
(1)A��E��
________________________________________________________��
(2)A��B��
_________________________________________________________��
(3)C��E��
__________________________________________________________��
���𰸡�BaCl2 AgNO3 HNO3 HCl K2CO3 ![]()
![]()
![]()
��������
C��E��D��E�������壬���������У������������ʵIJ��������ֻ��K2CO3����EΪK2CO3����C��DΪHNO3��HCl�е����ʣ���D��B�ܲ�����������DΪHCl����������������AgCl����������CΪHNO3��BΪAgNO3����AΪBaCl2��������ϸ����ʵ����ʽ��з�����
C��E��D��E�������壬���������У������������ʵIJ��������ֻ��K2CO3����EΪK2CO3����C��DΪHNO3��HCl�е����ʣ���D��B�ܲ�����������DΪHCl����������������AgCl����������CΪHNO3��BΪAgNO3����AΪBaCl2��
�ʴ�Ϊ��BaCl2��AgNO3��HNO3�� HCl��K2CO3��
(1) AΪBaCl2�� EΪK2CO3�����߷�Ӧ����BaCO3����Ӧ�����ӷ���ʽΪ��Ba2++CO32-=BaCO3�����ʴ�Ϊ��Ba2++CO32-=BaCO3����
(2)AΪBaCl2�� BΪAgNO3�����߷�Ӧ����AgCl����Ӧ�����ӷ���ʽΪAg++Cl-=AgCl�����ʴ�Ϊ��Ag++Cl-=AgCl����
(3) CΪHNO3��EΪK2CO3�� ���߷�Ӧ����CO2����Ӧ�����ӷ���ʽΪ2H++ CO32-=CO2��+H2O�� �ʴ�Ϊ��2H++ CO32-=CO2��+H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ҵ������N2��H2����ʵ�ֺϳɰ����������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش������й����⣺
��1����֪N2(g)+O2(g)=2NO(g) ��H =+180.5kJ��mol��1��N2(g)+3H2(g)![]() 2NH3(g) ��H =��92.4kJ��mol��1��2H2(g)+O2(g)=2H2O(g) ��H =��483.6kJ��mol��1��д����������������ȫ����һ��������ˮ�������Ȼ�ѧ����ʽΪ___________��
2NH3(g) ��H =��92.4kJ��mol��1��2H2(g)+O2(g)=2H2O(g) ��H =��483.6kJ��mol��1��д����������������ȫ����һ��������ˮ�������Ȼ�ѧ����ʽΪ___________��
��2����һ��������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g)![]() 2NH3(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2NH3(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t/K | 298 | 398 | 498 | ...... |
K/(mol/L)2 | 4.1��106 | K1 | K2 | ...... |
����������⣺
�ٱȽ�K1��K2�Ĵ�С��K1______K2(�>������=����<��)��
���ں��º�ѹ���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������______(�����)��
A��2v(H2)(��)=3v(NH3)(��) B��2v(N2) (��)=v(H2) (��)
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��3�����Ṥҵ��β��NO�������Ʊ�NH4NO3���乤��ԭ����ͼ��
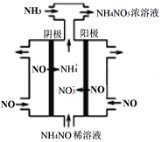
���������ĵ缫��ӦʽΪ___________��
�ڳ����£�1L pH=6��NH4NO3��Һ��c(NH3��H2O)+c(OH��)=________mol��L��1��
��4����ҵ���������صĻ�ѧ����ʽΪ��2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)����T�棬���Ϊ4L���ܱ������У�ͨ��6mol NH3��3mol CO2����Ӧ�ﵽƽ��ʱ��c(NH3)=0.5mol��L��1��c(CO2)=0.25mol��L��1������ʱ����T���ƽ��ʱ������ѹǿ���䣬��������ɱ�������г���3mol NH3�����ʱ��Ӧ��v��____ v��(�>����<����=��)���ٴ�ƽ���ƽ�ⳣ��Ϊ______��
CO(NH2)2(s)+H2O(l)����T�棬���Ϊ4L���ܱ������У�ͨ��6mol NH3��3mol CO2����Ӧ�ﵽƽ��ʱ��c(NH3)=0.5mol��L��1��c(CO2)=0.25mol��L��1������ʱ����T���ƽ��ʱ������ѹǿ���䣬��������ɱ�������г���3mol NH3�����ʱ��Ӧ��v��____ v��(�>����<����=��)���ٴ�ƽ���ƽ�ⳣ��Ϊ______��
����Ŀ�������ڹ�ũҵ������Ӧ�÷dz��㷺����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�á�
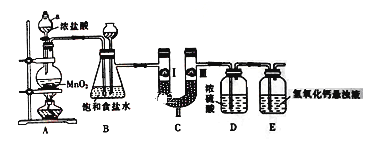
(1) ����a������Ϊ_______________��
(2) װ��B�б���ʳ��ˮ��������_________________��
(3) д��Aװ���з�����Ӧ�Ļ�ѧ����ʽ______________________
(4) װ��C����������֤�����Ƿ����Ư���ԣ�Ϊ��װ��C��I��II��III�����η���__________(����ĸ)��
ѡ�� | a | b | c |
I | ʪ�����ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
II | ��ʯ�� | Ũ���� | ��ˮ�Ȼ��� |
III | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
(5) װ��E��������������Һ��������___________________��ͬʱ��װ�ù�ҵ�Ͽ�������ȡƯ�ۣ���д����Ӧ��Ӧ�Ļ�ѧ����ʽ��___________________��