题目内容
【题目】实验室需纯净的NaCl晶体,但现有的NaCl晶体中混有少量的Na2SO4和NH4HCO3,为除去杂质,甲同学设计了如下实验:(已知NH4HCO3 ![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
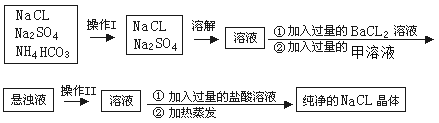
(1)上述操作I、II的名称分别为______、_______
(2)进行操作“加入过量的BaCl2溶液”时,如何判断BaCl2溶液已过量,其方法是______________________________________________________
(3)操作“加入过量的甲溶液”,甲溶液为______溶液,此操作的目的是________________________。
(4)操作“加入过量的盐酸溶液”的目的是________________________。
【答案】加热 过滤 取少量上层清液于试管中滴加氯化钡溶液,无沉淀出现,则说明氯化钡溶液过量 Na2CO3溶液 除去过量的钡离子 除去过量的碳酸钠
【解析】
NaCl晶体中混有少量的Na2SO4和NH4HCO3,加热固体,碳酸氢铵会分解生成氨气、二氧化碳和水蒸气,得到氯化钠和硫酸钠,溶于水得到溶液,加入过量氯化钡沉淀硫酸根离子,为了除去过量的钡离子,且在后续实验中容易除去引入的杂质,可加入过量碳酸钠溶液沉淀钡离子,过滤除去硫酸钡、碳酸钡沉淀,溶液中加入过量盐酸溶液除去碳酸钠,加热蒸发除去氯化氢得到氯化钠晶体,
(1)操作Ⅰ为加热分解碳酸氢铵,操作Ⅱ过滤除去硫酸钡和碳酸钡沉淀;
(2)进行操作“加入过量的BaCl2溶液”时,判断BaCl2溶液已过量,可以取反应后的上清液,检验是否还有硫酸根离子;
(3)为了除去过量的钡离子,且在后续实验中容易除去引入的杂质,可加入过量碳酸钠溶液沉淀钡离子;
(4)加入过量盐酸除去加入过量的碳酸钠。
NaCl晶体中混有少量的Na2SO4和NH4HCO3,加热固体,碳酸氢铵会分解生成氨气、二氧化碳和水蒸气,得到氯化钠和硫酸钠,溶于水得到溶液,加入过量氯化钡沉淀硫酸根离子,为了除去过量的钡离子,且在后续实验中容易除去引入的杂质,可加入过量碳酸钠溶液沉淀钡离子,过滤除去硫酸钡、碳酸钡沉淀,溶液中加入过量盐酸溶液除去碳酸钠,加热蒸发除去氯化氢得到氯化钠晶体,
(1)操作Ⅰ为加热分解碳酸氢铵,操作Ⅱ过滤除去硫酸钡和碳酸钡沉淀;
故答案为:加热;过滤;
(2)进行操作“加入过量的BaCl2溶液”时,判断BaCl2溶液已过量,可以取上层清液加入氯化钡观察是否有沉淀生成,从而判断氯化钡是否过量,若出现沉淀,证明未过量,若无沉淀,证明氯化钡过量;
故答案为:取少量上层清液于试管中滴加氯化钡溶液,无沉淀出现,则说明氯化钡溶液过量;
(3)为了除去过量的钡离子,且在后续实验中容易除去引入的杂质,可加入过量碳酸钠溶液沉淀钡离子;
故答案为:Na2CO3溶液;除去过量的钡离子;
(4)依据流程分析可知,加入过量盐酸除去加入过量的碳酸钠;
故答案为:除去过量的碳酸钠。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案