题目内容
1.工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的过程如下: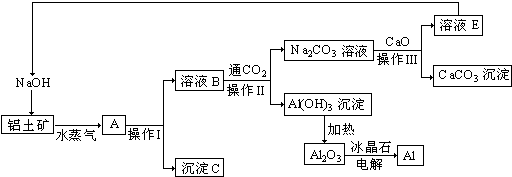
请回答下列问题:
(1)水蒸气的作用加热加快反应;
(2)沉淀C的化学式为Fe2O3,该物质除了用于金属冶炼以外,还可用作颜料(或炼铁);
(3)操作I、操作II、操作III都用到的玻璃仪器是有烧杯、漏斗、玻璃棒;
(4)实验室洗涤Al(OH)3沉淀应该如何操作用玻璃棒引流向过滤器中加水浸没沉淀,滤去洗液后,反复2~3次即可;
(5)写出制备过程中由溶液B生成Al(OH)3的离子方程式CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-、2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-;
(6)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有CaO和CO2(填化学式).用此法制取铝的副产品是Fe2O3和O2(填化学式).
分析 铝土矿中氧化铝和氧化铁,向铝土矿中加入NaOH溶液,发生反应Al2O3+2OH-═2AlO2-+H2O,氧化铁不溶于NaOH溶液,然后过滤,得到溶液B为NaOH、NaAlO2混合溶液,沉淀C为Fe2O3,向溶液B中通入CO2,发生反应2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-、2OH-+CO2=CO32-+H2O,然后过滤得到沉淀Al(OH)3和Na2CO3溶液,向溶液中加入CaO,发生反应Na2CO3+CaO+H2O═2NaOH+CaCO3↓,然后过滤,将NaOH循环利用;将Al(OH)3加热得到Al2O3,电解熔融Al2O3得到Al.
(1)温度高反应速率加快;
(2)根据氧化铝能与氢氧化钠反应,氧化铁与氢氧化钠不反应解答;氧化铁俗称为铁红,可作颜料或炼铁原料;
(3)固体和液体的分离用过滤的方法,操作Ⅰ、操作Ⅱ和操作Ⅲ都是过滤操作,根据过滤的操作过程和仪器组装来判断用到什么仪器;
(4)洗涤Al(OH)3沉淀应往漏斗中加入少量的蒸馏水,浸没沉淀,让其自然滤出,反复几次;
(5)碳酸酸性强于氢氧化铝,二氧化碳和偏铝酸根离子反应生成氢氧化铝和碳酸根离子、或碳酸氢根离子;
(6)生成的CaCO3受热分解得到CaO、CO2,可见CaO、CO2可循环使用,操作Ⅰ所得的Fe2O3和电解熔融Al2O3得到的O2为副产品.
解答 解:(1)水蒸汽流作用下加入氢氧化钠处理铝土矿,能够加快氢氧化钠与氧化铝反应,
故答案为:加热加快反应;
(2)水蒸汽流作用下加入氢氧化钠处理铝土矿,氧化铝能和氢氧化钠反应生成偏铝酸钠的水溶液,三氧化二铁不能与氢氧化钠发生反应,过滤,所得沉淀是不溶性的
Fe2O3,俗称铁红,除了用于金属冶炼以外,还可用作顔料,
故答案为:Fe2O3;颜料(或炼铁);
(3)实现固体和液体的分离采用过滤法,操作Ⅰ、操作Ⅱ和操作Ⅲ都是过滤操作,过滤时需要制作过滤器的漏斗、固定仪器的铁架台、引流用的玻璃棒、承接滤液的烧杯,
故答案为:烧杯、漏斗、玻璃棒;
(4)洗涤Al(OH)3沉淀应用玻璃棒引流向过滤器中加水浸没Al(OH)3沉淀,滤去洗液后,反复2~3次即可,
故答案为:用玻璃棒引流向过滤器中加水浸没沉淀,滤去洗液后,反复2~3次即可;
(5)通入过量CO2; 反应的离子方程式CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,通入少量CO2; 反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3+CO32-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-、2AlO2-+CO2+3H2O═2Al(OH)3+CO32-;
(6)煅烧碳酸钙得到CaO和CO2,B生成沉淀需要二氧化碳、碳酸钠转化为碳酸钙需要CaO,所以CaO和CO2能循环利用,操作Ⅰ所得的Fe2O3和电解熔融Al2O3得到的O2为副产品,
故答案为:CaO和CO2;Fe2O3和O2.
点评 本题考查物质分离和提纯,侧重考查学生分析及知识运用能力,明确物质性质及基本操作方法、反应原理即可解答,知道常见元素化合物知识及常见离子检验方法,题目难度中等.

 考前必练系列答案
考前必练系列答案| A. | BeCl2 | B. | C2H2 | C. | CO2 | D. | HCN |
| A. | C3H8 C5H12 | B. | C4H6 C3H4 | C. | C2H60 C3H8O | D. | C3H6O C2H4O |

(1)酸溶过程中为提高铁的浸出率,可采取的措施有适当提高反应温度(增加浸出时间;增大硫酸的浓度;研磨硫酸渣,增大固体表面积)(要求写出一条).“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 物质 | 熔点/℃ | 沸点 | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S,300℃以上完全分解,S2Cl2+Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2SCl2 |
②有关物质的部分性质如上表:
设计实验装置图如下:
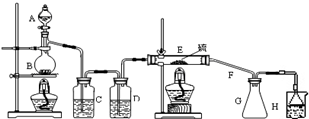
请回答下列问题:
(1)B 中反应的离子方程式MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;E 中反应的化学方程式2S+C12$\frac{\underline{\;\;△\;\;}}{\;}$S2C12.
(2)C、D 中的试剂分别是饱和食盐水、浓硫酸.
(3)如果在加热E时温度过高,对实验结果的影响是S2Cl2因温度过高会分解.
(4)根据S2Cl2的性质,在述实验装置中G、H之间应添加干燥装置.
| A. | (CH3)3CCH2Br | B. | CH3Br | C. | 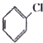 | D. |  |
| A. | 乙烯的结构简式可以表示为CH2CH2 | |
| B. | 苯、乙醇和乙酸都能发生取代反应 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 乙酸不能与NaHCO3溶液反应生成CO2 |
