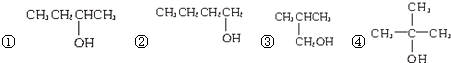题目内容
10.下列物质中能发生消去反应的是( )| A. | (CH3)3CCH2Br | B. | CH3Br | C. | 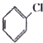 | D. |  |
分析 卤代烃发生消去反应结构特点:与-X相连碳相邻碳上有氢原子才能发生反应,形成不饱和键.
解答 解:A、(CH3)3CCH2Br中与溴原子相连碳相邻碳上没有氢原子,不能发生消去反应,故A错误;
B、CH3Br只含有1个碳原子,不能发生消去反应,故B错误;
C、 苯环上不能发生消去反应,故C错误;
苯环上不能发生消去反应,故C错误;
D、 中氯原子相连碳相邻碳上有氢原子,能发生消去反应生成环己烯,故D正确;
中氯原子相连碳相邻碳上有氢原子,能发生消去反应生成环己烯,故D正确;
故选D.
点评 本题主要考查卤代烃消去反应的特点,难度不大,根据所学知识即可完成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.A、B、C、D为短周期元素,在元素周期表中的位置如图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数.下列叙述不正确的是( )
| A | C | |
| B | D |
| A. | 气态氢化物的稳定性:HC>HD | |
| B. | 最高价氧化物对应水化物的酸性:H2BO4>HDO4 | |
| C. | 单质沸点最高的是B元素形成的单质 | |
| D. | A简单气态氢化物水溶液显碱性 |
5.下列基团名称正确的是( )
| A. | -CHO 羰基 | B. | -OH 羟基 | C. | -COOH 醛基 | D. | -NH2 硝基 |
15.下列实验操作和现象及其结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均变性了 |
| B | 将淀粉溶液和稀H2SO4混合加热后,再滴加新制的Cu(OH)2悬浊液,煮沸 | 无砖红色沉淀产生 | 淀粉未水解 |
| C | 向苯酚浓溶液中滴加少量溴水,振荡 | 无白色沉淀 | 苯酚与溴水不反应 |
| D | CH3COOH、C2H5OH和浓H2SO4共热制备CH3COOC2H5,将共热后产生的气体导入盛有饱和Na2CO3溶液的试管中 | 有油状物浮于Na2CO3溶液表面,振荡后,油状层变薄 | 证明油状物不全部是CH3COOC2H5 |
| A. | A | B. | B | C. | C | D. | D |
19.下表中是一些化学键键能的数据
根据上述数据回答(1)~(3)题
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2 C.Br2 D.I2
(2)X2+H2=2HX(X代表卤族原子)的反应是放热反应(填“吸热”或“放热”)
(3)相同条件下,等物质的量的X2(卤素单质)分别与足量的氢气反应,放出或吸收的热量最多的是F2.
| 化学键 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2 C.Br2 D.I2
(2)X2+H2=2HX(X代表卤族原子)的反应是放热反应(填“吸热”或“放热”)
(3)相同条件下,等物质的量的X2(卤素单质)分别与足量的氢气反应,放出或吸收的热量最多的是F2.
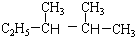 )的系统命名法的名称是2,3-二甲基戊烷;
)的系统命名法的名称是2,3-二甲基戊烷;