题目内容
6.下列分子中的中心原子的杂化方式都为sp杂化,分子的空间构型都为直线形,分子中没有形成π键的是( )| A. | BeCl2 | B. | C2H2 | C. | CO2 | D. | HCN |
分析 根据价层电子对互斥理论确定其杂化方式,如果价层电子对为2,则中心原子以sp杂化轨道成键,含有双键或三键时有π键,据此分析.
解答 解:A.BeCl2分子中,铍原子含有两个共价单键,不含孤电子对,所以价层电子对数是2,中心原子以sp杂化轨道成键,分子的空间构型都为直线形,分子中不含π键,故A选;
B.C2H2的结构简式为CH≡CH,含有三键,所以有π键,C原子采用sp杂化,分子的空间构型都为直线形,不符合题意,故B不选;
C.CO2的结构式为O=C=O,分子中含有碳碳双键,含有π键,C原子采用sp杂化,分子的空间构型都为直线形,不符合题意,故C不选;
D.HCN结构简式为H-C≡N,含有三键,所以有π键,碳原子杂化轨道数为2,所以采取sp杂化,所有原子处于同一直线共面,不符合题意,故D不选;
故选A.
点评 本题考查了杂化轨道理论,为高频考点,题目难度中等,根据价层电子对互斥理论来分析,明确价层电子对互斥理论内涵是解答关键.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
16.锂-碘电池可用来为心脏起能源,其电池反应可简化为:2Li+I2═2LiI.下列有关说法正确的是( )
| A. | I2发生氧化反应 | B. | 碘电极为该电池的负极 | ||
| C. | 正极反应为:Li-e-═Li+ | D. | 该电池放电时化学能转化为电能 |
17.下列事实能用勒夏特列原理来解释的是( )
| A. | 实验室采用排饱和食盐水的方法收集氯气 Cl2+H2O?H++Cl-+HClO | |
| B. | 500℃左右的温度比室温更有利于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0 | |
| C. | H2、I2、HI平衡混合气体加压后颜色加深 H2(g)+I2(g)?2HI(g) | |
| D. | SO2氧化为SO3,往往需要使用催化剂 2SO2(g)+O2(g)?2SO3(g) |
1.乙醇分子结构式如图所示,下列反应及断键部位不正确的是( )


| A. | 乙醇与钠的反应是①键断裂 | |
| B. | 乙醇的催化氧化反应是②③键断裂 | |
| C. | 乙醇的燃烧氧化反应是所有化学键都断裂 | |
| D. | 乙醇与乙酸发生酯化反应是①键断裂 |
11.下列物质中,酸性最强的是( )
| A. | 乙醇 | B. | 碳酸 | C. | 苯酚 | D. | 乙酸 |
18.下列实验事实不能用基团间相互作用来解释的是( )
| A. | 苯酚能与NaOH溶液反应而乙醇不能 | |
| B. | 与Na反应时,乙醇的反应速率比水慢 | |
| C. | 乙醇能被酸性重铬酸钾溶液氧化而乙酸不能 | |
| D. | 苯、甲苯发生硝化反应生成一硝基取代产物时,甲苯的反应温度更低 |

 .
. .
. .
.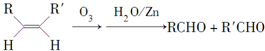
 )的系统命名法的名称是2,3-二甲基戊烷;
)的系统命名法的名称是2,3-二甲基戊烷;
