题目内容
16.某溶液仅含Fe2+、Na+、A13+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入少量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是( )| A. | 若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| B. | 若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 | |
| C. | 该溶液中所含的离子是Fe2+、Na+、SO42-、NO3- | |
| D. | 若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
分析 向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变,则一定发生Fe2+、NO3-的氧化还原反应生成硝酸铁和NO,阴离子种类不变,则原溶液中存在SO42-,又溶液中含有四种离子,所含离子的物质的量均为1mol,由电荷守恒可知,含有带一个单位正电荷的阳离子,以此来解答.
解答 解:向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变,则一定发生Fe2+、NO3-的氧化还原反应生成硝酸铁和NO,由于加入稀硫酸后,阴离子种类不变,则原溶液中存在SO42-,又溶液中含有四种离子,所含离子的物质的量均为1mol,由电荷守恒可知,含有带一个单位正电荷的阳离子,即一定含有Na+,
A、该溶液中加酸发生氧化还原反应生成铁离子,则加KSCN溶液,溶液显血红色,故A正确;
B、生成的NO易被氧化成红棕色的二氧化氮,故B正确;
C、由上述推断可知,该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-,故C正确;
D、若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体为氧化铁,其质量为0.5mol×160g/mol=80g,故D错误,故选D.
点评 本题考查离子的检验,明确常见离子的性质及检验中发生的化学反应是解答本题的关键,注意检验中应排除离子的相互干扰来解答,并注意离子共存及电荷守恒的应用,题目难度中等.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
6.下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
| A. | 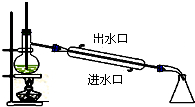 石油的蒸馏 | B. | 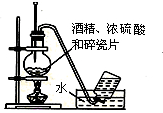 实验室用乙醇制乙烯 | ||
| C. | 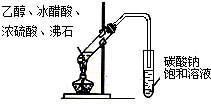 实验室制取乙酸乙酯 | D. | 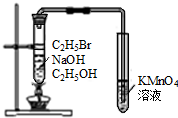 验证溴乙烷发生消去反应 |
7.下列说法正确的是( )
| A. | 某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 | |
| B. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 | |
| C. | 分子组成相差一个或几个CH2原子团的有机物是同系物 | |
| D. | 在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区域空间出现概率的大小 |
4.X、Y、Z均是短周期元素,X、Y位于同一周期,X、Z的最低价离子分别为X2-和Z-,且Y+和Z-离子具有相同的电子层结构.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 对应气态氢化物的稳定性:X>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
11.下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族)第二周期第ⅥA族.
(2)8种元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式).
(3)①元素和⑥元素形成化合物的电子式是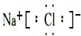 .
.
(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
(5)下列叙述正确的是ABD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)⑧在元素周期表中的位置是(周期、族)第二周期第ⅥA族.
(2)8种元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式).
(3)①元素和⑥元素形成化合物的电子式是
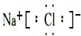 .
.(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
(5)下列叙述正确的是ABD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
1.如图是研究铁钉腐蚀的装置图,下列说法正确的是( )
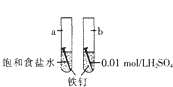

| A. | a是吸氧腐蚀,b是化学腐蚀 | |
| B. | a的负极反应时Fe-3e-═Fe3+ | |
| C. | a、b两处铁钉用导线联通有电流通过 | |
| D. | b前期发生析氢腐蚀,后期发生吸氧腐蚀 |
8.碳酸钠中含有少量硫酸钠,下列是测定样品纯度的方案:
方案一 样品$\stackrel{CaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
方案二 样品$\stackrel{BaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
下列叙述正确的是( )
方案一 样品$\stackrel{CaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
方案二 样品$\stackrel{BaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
下列叙述正确的是( )
| A. | 方案一优于方案二,因为CaCl2比BaCl2更便宜 | |
| B. | 方案一优于方案二,因为其沉淀物溶解度更小沉淀更安全 | |
| C. | 用乙醇洗涤沉淀比用水洗涤,测量结果更准确 | |
| D. | 以上两种方案都必须采集样品的质量、沉淀剂和沉淀物的质量 |
5.几种短周期元素的原子半径及主要化合价如表所示:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | Z的最高价含氧酸分子式为H3ZO4 | |
| C. | Y的最高价氧化物对应的水化物能溶于氢氧化钠溶液 | |
| D. | Z的氢化物比W的氢化物稳定 |
17.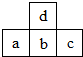 图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
 图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是c>b>a>d | |
| B. | c的氢化物比a的氢化物稳定 | |
| C. | b和d可结合成bd32-和bd42-阴离子 | |
| D. | a、b、c的最高价氧化物对应水化物的酸性强弱关系是c>b>a |