题目内容
19.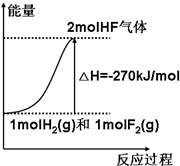 已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )
已知:H2(g)+F2(g)=2HF(g)△H=-270kJ/mol[表示1mol H2(g)与1mol F2(g)化合生成2mol HF(g)放出270kJ热量],下列说法正确的是( )| A. | 该反应的逆反应是放热反应 | |
| B. | 该反应过程的能量变化可用右图来表示 | |
| C. | 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量小于270 kJ | |
| D. | 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量 |
分析 由热化学方程式可知,正反应△H<0,为放热反应,说明反应物总能量大于生成物总能量,物质由气体变为液体放出能量,以此解答该题.
解答 解:A.正反应△H<0,为放热反应,该反应的逆反应是吸热反应,故A错误;
B.由热化学方程式可知,正反应△H<0,为放热反应,说明反应物总能量大于生成物总能量,故B错误;
C.物质由气体变为液体放出能量,则1mol H2与1mol F2反应生成2mol液态HF放出的热量大于270kJ,故C错误;
D.由热化学方程式可知,正反应△H<0,为放热反应,说明反应物总能量大于生成物总能量,故D正确.
故选D.
点评 本题考查反应热与焓变,为高频考点,侧重于学生的分析能力的考查,注意把握物质的能量与反应热的关系,把握热化学方程式的特点,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
9.一定量的氢气在一定条件下完全燃烧生成气态水,放出热量值为Q1,等量的氢气在同样条件下完全燃烧生成液态水,放出热量值为Q2,Q1与Q2的关系为( )
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 无法确定 |
7.下列说法正确的是( )
| A. | 某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 | |
| B. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 | |
| C. | 分子组成相差一个或几个CH2原子团的有机物是同系物 | |
| D. | 在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区域空间出现概率的大小 |
14.化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 无论是风力发电还是火力发电,都是将化学能转化为电能 | |
| C. | PM2.5含有的铅、铬、钒、砷等对人体有害的金属元素 | |
| D. | 煤、石油、天然气是一级能源 |
4.X、Y、Z均是短周期元素,X、Y位于同一周期,X、Z的最低价离子分别为X2-和Z-,且Y+和Z-离子具有相同的电子层结构.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 对应气态氢化物的稳定性:X>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
11.下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族)第二周期第ⅥA族.
(2)8种元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式).
(3)①元素和⑥元素形成化合物的电子式是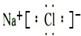 .
.
(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
(5)下列叙述正确的是ABD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)⑧在元素周期表中的位置是(周期、族)第二周期第ⅥA族.
(2)8种元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式).
(3)①元素和⑥元素形成化合物的电子式是
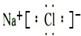 .
.(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
(5)下列叙述正确的是ABD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
8.碳酸钠中含有少量硫酸钠,下列是测定样品纯度的方案:
方案一 样品$\stackrel{CaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
方案二 样品$\stackrel{BaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
下列叙述正确的是( )
方案一 样品$\stackrel{CaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
方案二 样品$\stackrel{BaCl_{2}}{→}$过滤$\stackrel{洗涤、干燥}{→}$称量
下列叙述正确的是( )
| A. | 方案一优于方案二,因为CaCl2比BaCl2更便宜 | |
| B. | 方案一优于方案二,因为其沉淀物溶解度更小沉淀更安全 | |
| C. | 用乙醇洗涤沉淀比用水洗涤,测量结果更准确 | |
| D. | 以上两种方案都必须采集样品的质量、沉淀剂和沉淀物的质量 |
20.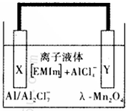 铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )
铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )
 铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )
铝是一种高能量载体,是开发电池的理想电极材料.如图所示的室温铝二次电池,采用有机阳离子(EMlm)和 AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4$?_{充电}^{放电}$AlMn2O4 下列说法正确的是( )| A. | 电池放电时,Ac-4-向Y极扩散 | |
| B. | 电池放电时,X是正极 | |
| C. | 电池充电时X极的反应为:4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 铝作为负极材料的比能量高于锂 |
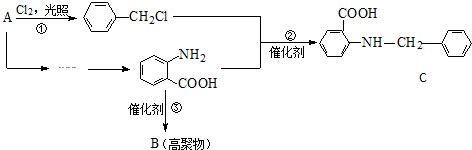
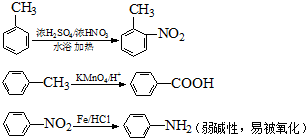
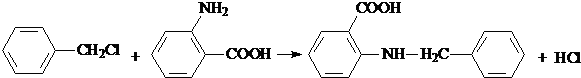 .
. 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式:
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式: 、
、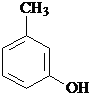 、
、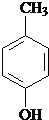 .
.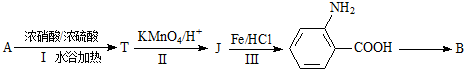
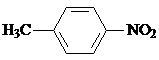 .
.