题目内容
6.某同学为了探究外界条件对化学反应速率的影响,用50mL稀盐酸和1g碳酸钙在不同条件下反应,得到如下表数据.请仔细观察下表中实验数据,回答下列问题:| 实验. 序号 | 碳酸钙 | C(HCl)/ mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
(2)实验5、6目的是探究温度对反应速率的影响,结果说明当其他条件相同时,温度越高,反应速率越快.
(3)根据实验1、3、5或实验2、4可以得出条件对反应速率的影响规律是其他条件一定,反应物浓度越大,反应速率越快.
(4)从本实验数据中分析,影响化学反应速率的因素还有反应物的接触面积,能表明这一规律的两个实验序号是1和2.
分析 影响反应速率的因素有固体表面积、溶液的浓度、温度、压强以及催化剂等,解答本题时注意从几个变量的对比①固体的状态,②盐酸的浓度,③温度的变化,④反应时间等,通过对比可得出不同外界条件对化学反应速率的影响,以此解答该题.
解答 解:(1)通过表中数据,对比反应前后温度变化可知,反应后溶液温度升高,则反应为放热反应,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:放热;CaCO3+2H+=Ca2++CO2↑+H2O;
(2)由实验5和6实验数据可知,其他条件相同时,温度越高,碳酸钙消失的所用时间越少,说明温度越高,反应速率越大,
故答案为:温度;温度越高;
(3)实验1、3、5相同的地方是固体的形状相同,反应前的温度相同,但反应物的浓度依次增大,碳酸钙消失的所用时间依次减少,说明反应物浓度越大,反应速率越快,
故答案为:其他条件一定,反应物浓度越大,反应速率越快;
(4)1、2数据反应温度相同,盐酸的浓度相同,但固体的形状不同,实验数据标明粉末时的反应速率大于粒状,则可说明接触面积越大,反应速率越大,
故答案为:反应物的接触面积;1和2.
点评 本题考查外界条件对反应速率影响的实验探究,题目难度不大,注意培养对图表数据的分析能力.

练习册系列答案
相关题目
16.下列表示物质的化学用语或模型正确的是( )
| A. | 羟基的电子式: | B. | CH4分子的比例模型: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 1,2-二甲基丁烷的结构简式为: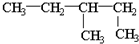 |
17.25℃时,下列溶液的离子浓度关系式正确的是( )
| A. | pH=a的醋酸溶液稀释10倍后,其pH=b,则b=a+1 | |
| B. | 浓度相同的①NH4Cl;②CH3COONH4;③NH4HSO4三种溶液的c(NH4+):①>③>② | |
| C. | 浓度相同的氨水与盐酸等体积混合:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 将amol•L-1CH3COOH与bmol•L-1NaOH溶液等体积混合,测得溶液pH为7,则a>b |
14.化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 无论是风力发电还是火力发电,都是将化学能转化为电能 | |
| C. | PM2.5含有的铅、铬、钒、砷等对人体有害的金属元素 | |
| D. | 煤、石油、天然气是一级能源 |
1.如表所示的五种元素W、X、Y、T、Z均为短周期元素,且这五种元素的原子最外层电子数之和为26.下列说法正确的是( )
| W | X | Y | |
| T | Z | ||
| M |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质TY2、WZ4在通常情况下状态相同 | |
| D. | M元素的单质具有半导体的特性,M与Z元素可形成化合物MZ4 |
11.下列是部分短周期中第二、第三周期元素的原子半径及主要化合价.
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族)第二周期第ⅥA族.
(2)8种元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式).
(3)①元素和⑥元素形成化合物的电子式是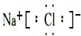 .
.
(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
(5)下列叙述正确的是ABD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
(1)⑧在元素周期表中的位置是(周期、族)第二周期第ⅥA族.
(2)8种元素的最高价氧化物的水化物中,酸性最强的是HClO4(填化学式).
(3)①元素和⑥元素形成化合物的电子式是
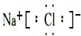 .
.(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
(5)下列叙述正确的是ABD(填字母).
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性.
18.NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 19gH3O+共用的电子对数为2NA | |
| B. | 34gD2O2所含电子数为18NA | |
| C. | 1mol羟基(-16OH) 所含中子数为8NA | |
| D. | D16OD、T16OH共10g,所含中子数各为0.25NA |
15.如图为元素周期表短周期的一部分.其中W元素的最高正价与最低负价的代数和为4.下列有关说法正确的是( )
| X | |||
| Z | Y | W |
| A. | X、Y、W的氧化物都属于酸性氧化物 | |
| B. | 工业上采用电解Z的氯化物制备Z单质 | |
| C. | W的单质易溶于XW2 | |
| D. | 1molX或Y的最高价氧化物分子中都含有2mol双键 |
7.下列图示中,表示反应是吸热反应的是( )
| A. | 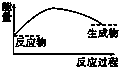 | B. | 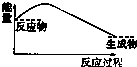 | C. | 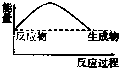 | D. | 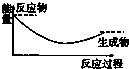 |