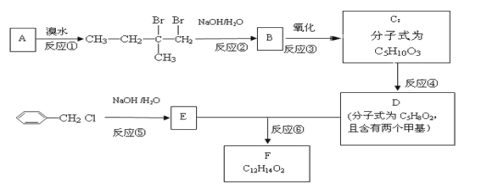
题目内容
【题目】由两种元素组成的化合物X,是现代工业的重要原料。为探究X的组成,设计并进行如下实验:
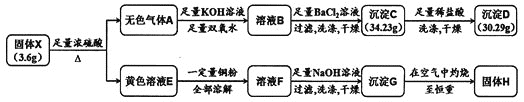
(1)将黄色溶液E稀释后通入无色气体A,发生反应的离子方程式为______________。
(2)除![]() 外,溶液F中一定含有的金属阳离子为________,其检验方法为______________。
外,溶液F中一定含有的金属阳离子为________,其检验方法为______________。
(3)固体X与浓硫酸反应的化学方程式是_________________。
(4)若测得固体H的质量为![]() ,则溶液E溶解的铜粉质量为________。
,则溶液E溶解的铜粉质量为________。
【答案】2Fe3++SO2+2H2O=2Fe3++SO42-+4H+ ![]() 取样,滴入少量硫酸酸化的高锰酸钾溶液,若紫红色立即褪去,则证明溶液中含有
取样,滴入少量硫酸酸化的高锰酸钾溶液,若紫红色立即褪去,则证明溶液中含有![]() 或取样,滴入少量铁氰化钾溶液,若出现蓝色沉淀,则证明溶液中含有
或取样,滴入少量铁氰化钾溶液,若出现蓝色沉淀,则证明溶液中含有![]()
![]() 浓
浓![]()
![]()
【解析】
由图中转化关系可知沉淀D为![]() ,其物质的量为
,其物质的量为![]() ,沉淀C为
,沉淀C为![]() 和
和![]() 的混合物,
的混合物,![]() 的物质的量为
的物质的量为![]() ,则无色气体A为
,则无色气体A为![]() 和
和![]() ,黄色溶液E为
,黄色溶液E为![]() 溶液,故固体X中含有Fe和C两种元素。由原子守恒可知,Fe元素的质量为
溶液,故固体X中含有Fe和C两种元素。由原子守恒可知,Fe元素的质量为![]() ,则
,则![]() ,则固体X中Fe与C原子个数比为
,则固体X中Fe与C原子个数比为![]() ,故X的化学式为
,故X的化学式为![]() ,据此分析解答本题。
,据此分析解答本题。
(1)结合以上分析,黄色溶液E为硫酸铁溶液,稀释后通入无色气体A,铁离子与二氧化硫发生氧化还原反应,发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe3++SO42-+4H+;
(2)黄色溶液E为硫酸铁溶液加入一定量铜粉,则反应生成硫酸亚铁和硫酸铜,则溶液F中除![]() 外,一定含有的金属阳离子为
外,一定含有的金属阳离子为![]() ,其检验方法为取样,滴入少量硫酸酸化的高锰酸钾溶液,若紫红色立即褪去,则证明溶液中含有
,其检验方法为取样,滴入少量硫酸酸化的高锰酸钾溶液,若紫红色立即褪去,则证明溶液中含有![]() 或取样,滴入少量铁氰化钾溶液,若出现蓝色沉淀,则证明溶液中含有
或取样,滴入少量铁氰化钾溶液,若出现蓝色沉淀,则证明溶液中含有![]() ;
;
(3)固体X与浓硫酸反应的化学方程式是![]() 浓
浓![]() ;
;
(4)固体H为CuO和![]() 的混合物,固体X中含有的Fe元素的物质的量为
的混合物,固体X中含有的Fe元素的物质的量为![]() ,根据原子守恒可知,生成的
,根据原子守恒可知,生成的![]() 的物质的量为
的物质的量为![]() ,其质量为
,其质量为![]() ,则CuO的质量为
,则CuO的质量为![]() ,其物质的量为
,其物质的量为![]() ,根据Cu原子守恒可知,溶液E溶解的铜粉物质的量为
,根据Cu原子守恒可知,溶液E溶解的铜粉物质的量为![]() ,质量为
,质量为![]() 。
。

【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定反应过程中产生氢气体积V,根据相关数据所绘制的图象如图所示,则曲线a、b、c、d所对应的实验组别可能依次是( )
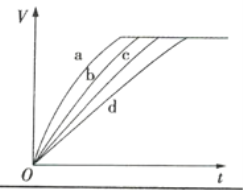
实验组别 | c(HCl)/(mol·L-1) | 温度/℃ | 形状(Fe) |
1 | 2.0 | 30 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
A.4、3、2、1B.1、2、3、4
C.3、4、2、1D.1、2、4、3
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
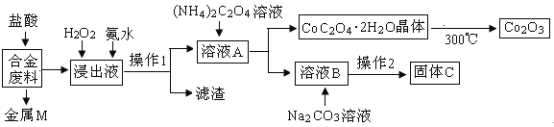
(1)金属M为__________,操作1为___________。
(2)加入H2O2的作用是(用离子方程式表示)________,加入氨水的作用是________。
(3)充分焙烧的化学方程式为____________。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是___________,90℃时Ksp(Li2CO3)的值为___________。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为__________。
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g)。各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
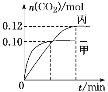
反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.乙容器中反应达到平衡时,N2的转化率小于40%
C.达到平衡时,乙容器中的压强一定大于甲容器的2倍
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时υ(正)<υ(逆)