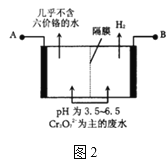
题目内容
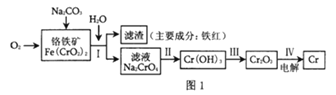
【题目】某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解 |
(1)实验室用18.4molL-1的浓硫酸配制250mL4.8molL-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和移液管(一种能精确量取一定体积液体的仪器)外,还需___。
(2)酸浸时,为了提高浸取率可采取的措施是___(至少两条)。
(3)加入H2O2的作用是___。
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是___。
(5)还原过程发生以下反应(请配平):__Na2Cr2O7+__SO2+__=__Cr(OH)(H2O)5SO4+__Na2SO4;
(6)从流程的滤液中可回收的主要物质是___。
【答案】250mL容量瓶、胶头滴管 升高反应温度、搅拌(或增加浸取时间、滤渣多次浸取等) 氧化+3价Cr使之转变成+6价Cr(或Cr2O72-),以便于与杂质离子分离 Ca2+、Mg2+ 1 3 11H2O 2 1 Na2SO4
【解析】
(1)由浓硫酸配制250mL4.8mol/L硫酸溶液所需的玻璃仪器有:烧杯、玻璃棒、移液管、250mL容量瓶和胶头滴管;
(2)酸浸时,升高反应温度、增加浸取时间、不断搅拌混合物、滤渣多次浸取等能提高浸取率;
(3)双氧水有强氧化性,能氧化还原性的物质;H2O2氧化后的溶液中加入NaOH调pH=8,Fe3+、Al3+转化为沉淀除去;
(4)钠离子交换树脂交换的离子是钙离子和镁离子;
(5)二氧化硫具有还原性,被离子交换后溶液中的Na2Cr2O7氧化为硫酸根,Na2Cr2O7被还原为Cr(OH)(H2O)5SO4;
(6)从流程的滤液中可回收的主要物质是硫酸钠。
(1)由浓硫酸配制250mL4.8mol/L硫酸溶液所需的玻璃仪器有:烧杯、玻璃棒、移液管、250mL容量瓶和胶头滴管;
(2)酸浸时,为了提高浸取率可采取的措施是:升高反应温度、增加浸取时间、不断搅拌混合物、滤渣多次浸取等;
(3)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,能被双氧水氧化为+6价的Cr,以便于与杂质离子分离;经H2O2氧化后的溶液中加入NaOH溶液使溶液呈碱性,溶液pH=8,根据表中数据知,Fe3+、Al3+转化为沉淀除去;
(4)钠离子交换树脂交换的离子是钙离子和镁离子;
(5)二氧化硫具有还原性,被离子交换后溶液中的Na2Cr2O7氧化为硫酸根,Na2Cr2O7被还原为Cr(OH)(H2O)5SO4,依据得失电子守恒、原子守恒配平,Na2Cr2O7+3SO2+11H2O =2Cr(OH)(H2O)5SO4+Na2SO4;
(6)从流程的滤液中可回收的主要物质是硫酸钠。

 阅读快车系列答案
阅读快车系列答案【题目】I.根据表格信息,请回答下列问题:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
(1)反应①是________(填“吸热”或“放热”)反应。
(2)写出反应③的平衡常数K3的表达式_______________________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示)。
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有____(填写字母序号)。
A.缩小反应容器的容积B.扩大反应容器的容积
C.升高温度D.使用合适的催化剂
E.设法减小平衡体系中的CO浓度
(5)若反应③的逆反应速率与时间的关系如图所示:
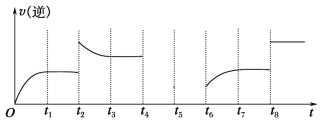
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。__________
Ⅱ.25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式__________