题目内容
13.设NA为阿伏加德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,11.2 L SO3所含的氧原子数为1.5NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
分析 A.气体摩尔体积使用对象为气体;
B.粗铜中含有还原性强于铜的杂质铁、锌,电解过程中优先放电;
C.过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
D.铝离子为弱碱阳离子,水溶液中部分发生水解.
解答 解:A.标况下,三氧化硫不是气体,不能使用气体摩尔体积,故A错误;
B.电解精炼铜时,阳极粗铜中含有活泼性较强的铁、锌等杂质,电解时铁、锌杂质先放电,且铁摩尔质量小于铜的64g/mol,锌的摩尔质量大于铜的摩尔质量,所以阳极减少6.4g,转移的电子的物质的量不一定为0.2mol,故B错误;
C.7.8g Na2S和Na2O2的物质的量为:7.8g78g/mol=0.1mol,过氧化钠中阳离子为过氧根离子,硫化钠中阴离子为硫离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数等于0.1NA,故C正确;
D.铝离子为弱碱阳离子,水溶液中部分发生水解,在含Al3+总数为NA的AlCl3溶液中,Cl-总数大于3NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意明确标况下气体摩尔体积的使用条件,注意过氧化钠的构成,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
3.固体X只可能由A1、(NH4)2SO4、MgCl2、FeCl2、AlCl3、AgNO3中的一种或几种组成,某同学对该固体进行了如图实验,下列判断正确的是( )
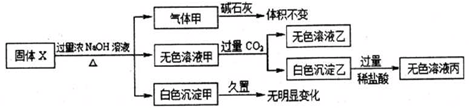

| A. | 气体甲一定是纯净物 | |
| B. | 将过量的无色溶液乙和少量无色溶液丙混合既有无色气体生成,也有白色沉淀生成 | |
| C. | 固体X中一定存在AlCl3、(NH4)2SO4,MgCl2 | |
| D. | 白色沉淀甲可能是混合物 |
4.下列说法正确的是( )
| A. | 含有CH3COONa的溶液都能增大水的电离程度 | |
| B. | pH=5的HCl与pH=5的NH4Cl等体积混合,溶液pH仍为5 | |
| C. | 将AgI和AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,产生的沉淀主要是AgBr | |
| D. | 20mL0.1mol/LNH3•H2O与10mL0.1mol/LHCl充分反应,所得溶液pH=9中c(NH3•H2O)>c(Cl-)>c(OH-) |
1.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 采用催化措施,将汽车尾气中的CO和NO转化为无害气体 | |
| B. | 合金材料中不可能含有非金属元素 | |
| C. | 信息产业中的光缆的主要成分是单质硅 | |
| D. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 |
8.下列描述正确的是( )
| A. | 二氧化硫不可用作食品防腐剂 | |
| B. | 裂化汽油与植物油使溴水褪色的原理相同 | |
| C. | 废旧电池中含有重金属离子,故应集中回收,填埋处理 | |
| D. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 |
5.标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是( )
| A. | H2S | B. | O2 | C. | H2S、SO2 | D. | SO3 |
7.aX、bY、dZ、W是四种短周期主族元素(只有一种是金属),b-a=d-b=1,Z与W可形成两种常见的化合物,其中一种(Q)有强氧化性且在航天、潜水过程中有极为重要的用途,下列说法中正确的是( )
| A. | Q中只有离子键 | |
| B. | 原子半径W>Z>Y>X | |
| C. | Y元素可形成两种含氧酸,且这两种含氧酸均为强酸 | |
| D. | 最简单氢化物的稳定性Z>Y>X,沸点Z>Y>X |
 .
.
 :
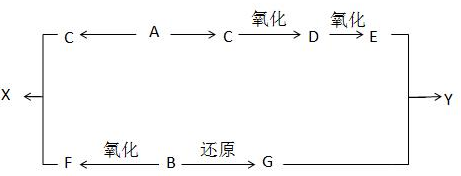
:
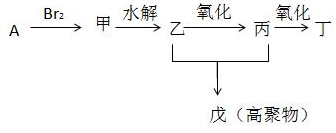
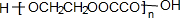
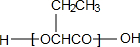 .
.