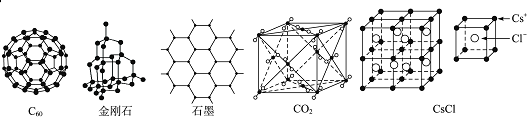
题目内容
18.下列各组原子序数所表示的两种元素,能形成AB2型共价化合物的是( )| A. | 6和8 | B. | 1和7 | C. | 11和16 | D. | 12和17 |
分析 根据物质的化学式为AB2,可判断A的化合价可能为+2价或+4价,B的化合价可能为-1价或-2价,根据常见元素的化合价以及是否共价化合物进行推断,另外N元素也能形成+4价氧化物.
解答 解:A、原子序数为6的元素为C,原子序数为8的元素为O,二者生成CO2,为共价化合物,则能形成AB2型共价化合物,故A正确;
B、原子序数为1的元素为H,原子序数为7的元素为N,二者生成NH3,为共价化合物,故B错误;
C、原子序数为11的元素为Na,原子序数为16的元素为S,二者生成Na2S,为离子化合物,故C错误;
D、原子序数为12的元素为Mg,原子序数为17的元素为Cl,二者生成MgCl2,为离子化合物,故D错误.
故选A.
点评 本题考查AB2型物质的推断,题目难度不大,注意从化合价和共价化合物的角度分析.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
9.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2molN2;的和0.6molH2的,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2mol.则前5分钟的平均反应速率v( N2)=0.01mol/(L•min).
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0
,其化学平衡常数K与温度T的关系如表所示:
请完成下列问题:
①试比较K1、K2 的大小,K1>K2 (填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是BC(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g) 的化学平衡常数为2.当测得NH3、N2
和H2 物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正>v(N2)逆(填“<”、“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
(1)若在一容积为2L的密闭容器中加入0.2molN2;的和0.6molH2的,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2mol.则前5分钟的平均反应速率v( N2)=0.01mol/(L•min).
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0
,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2 的大小,K1>K2 (填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是BC(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g) 的化学平衡常数为2.当测得NH3、N2
和H2 物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正>v(N2)逆(填“<”、“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
3.25℃时,物质的量浓度相等的NaHCO3、CH3COONa混合溶液中,下列有关说法或粒子浓度关系正确的是(Ka表示CH3COOH的电离平衡常数).
| A. | pH可能等于7 | |
| B. | c(HCO3- )=c(CH3COO-) | |
| C. | c(OH-)=$\frac{c(C{H}_{3}COOH)Kw}{c(C{H}_{3}CO{O}^{-})Ka}$ | |
| D. | c(HCO3- )+c(H2CO3)+c(CO3 2-)=c(CH3COOH)+c(CH3COO-) |
10.常温下,2L物质的量浓度为0.5mol•L-1Ba(OH)2溶液含有( )
| A. | 0.5mol的Ba2+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 2.0mol的OH- |
7.某元素的原子结构示意图为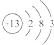 ,下列关于该元素的说法中,错误的是( )
,下列关于该元素的说法中,错误的是( )
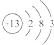 ,下列关于该元素的说法中,错误的是( )
,下列关于该元素的说法中,错误的是( )| A. | 它的阳离子带3个单位正电荷 | B. | 它是一种金属元素 | ||
| C. | 它的阳离子有10个质子 | D. | 其原子核外有13个电子 |
 ;
;