题目内容
10.常温下,2L物质的量浓度为0.5mol•L-1Ba(OH)2溶液含有( )| A. | 0.5mol的Ba2+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 2.0mol的OH- |
分析 根据n=cV计算Ba(OH)2的物质的量,溶液中Ba(OH)2完全电离n(Ba+)=n[Ba(OH)2)],溶液中OH-离子来源于Ba(OH)2、水的电离甚少,H+来源于水的电离,碱性条件下其浓度很小,根据Kw计算氢离子的浓度并计算其物质的量.
解答 解:A、溶液中Ba(OH)2的物质的量=2L×0.5mol/L=1mol,溶液中Ba(OH)2完全电离n(Ba+)=n[Ba(OH)2)]=1mol,故A错误;
B、Ba(OH)2电离的OH-为2mol,浓度是1mol/L,所以氢离子浓度是$\frac{1{0}^{-14}}{1}$mol/L,物质的量是2×10-14mol,故B错误;
C、Ba(OH)2电离的OH-为2mol,浓度是1mol/L,所以氢离子浓度是$\frac{1{0}^{-14}}{1}$mol/L,物质的量是2×10-14mol,故C错误;
D、溶液中Ba(OH)2的物质的量=2L×0.5mol/L=1mol,电离的OH-为2mol,故D正确.
故选D.
点评 本题考查物质的量浓度有关计算,难度不大,注意基础知识的梳理是关键.

练习册系列答案
相关题目
15.现有7种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯.其中既能使酸性KMnO4 溶液褪色,又能与溴水反应使溴水褪色的是( )
| A. | ②③ | B. | ④⑥⑦ | C. | ①④⑥⑦ | D. | ②③⑤⑦ |
18.下列各组原子序数所表示的两种元素,能形成AB2型共价化合物的是( )
| A. | 6和8 | B. | 1和7 | C. | 11和16 | D. | 12和17 |
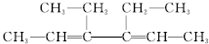
2.下列关于有机物 的说法不正确的是( )
的说法不正确的是( )
 的说法不正确的是( )
的说法不正确的是( )| A. | 所有的碳原子在同一个平面上 | |
| B. | 能够发生加成反应 | |
| C. | 不能发生消去反应 | |
| D. | 水解生成的有机物可与NaOH溶液反应 |
19.新制氯水与久置氯水相比较,下列说法错误的是( )
| A. | 颜色不同 | B. | 都能使滴有酚酞的NaOH溶液褪色 | ||
| C. | 都能使有色布条褪色 | D. | 加AgNO3溶液都能生成白色沉淀 |
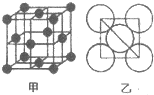
20.根据如表提供的信息,下列判断错误的是( )
| 第一周期 | 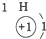 | ||
| 第二周期 | 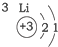 |  | 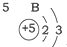 |
| 第三周期 | 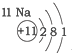 | 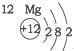 | 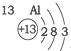 |
| A. | 元素所在的周期数等于其原子的电子层数 | |
| B. | 原子序数与元素原子核电荷数在数值上相同 | |
| C. | 第二、三周期元素的原子从左至右最外层电子数逐渐增多 | |
| D. | 金属元素的原子,其最外层电子数一般少于4个,在化学反应中易得到电子,趋向达到相对稳定结构 |