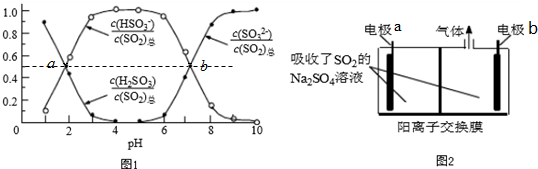
题目内容
8.A、B、C、D四种元素都是短周期元素.A元素的离子具有黄色的焰色反应.B离子带两个单位正电荷,且B元素的离子结构和Ne具有相同的电子层排布.H2在C单质中燃烧产生苍白色火焰.D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍.根据上述条件,回答:(1)元素C位于元素周期表中的位置第三周期第ⅤⅡA族,它的最高价氧化物的化学式为Cl2O7.
(2)A是Na元素,B是Mg元素,
D是O元素.
(3)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(4)A的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为OH-+H+=H2O.
分析 A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应,则A为Na元素;B离子带两个单位正电荷,且B元素的离子结构和Ne具有相同的电子层排布,则B的质子数为12,为Mg元素;H2在C单质中燃烧产生苍白色火焰,则C为Cl元素;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍,则次外层为2,最外层电子为6,D为O元素,然后利用元素及其单质、化合物的性质来解答.
解答 解:A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应,则A为Na元素;B离子带两个单位正电荷,且B元素的离子结构和Ne具有相同的电子层排布,则B的质子数为12,为Mg元素;H2在C单质中燃烧产生苍白色火焰,则C为Cl元素;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍,则次外层为2,最外层电子为6,D为O元素,
(1)C为Cl元素,位于元素周期表中第三周期第ⅤⅡA族,最高价为+7价,它的最高价氧化物化学式为Cl2O7,
故答案为:第三周期第ⅤⅡA族;Cl2O7;
(2)由上述推断可知,A为Na,B为Mg,D为O元素,
故答案为:Na;Mg;O;
(3)C元素的单质为Cl2,A的最高价氧化物对应的水化物为NaOH,二者反应的离子反应为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)A的最高价氧化物的水化物额NaOH,C的最高价氧化物的水化物为高氯酸,氢氧化钠与高氯酸反应中和反应生成高氯酸钠和水,反应的离子方程式为:OH-+H+=H2O,
故答案为:OH-+H+=H2O.
点评 本题考查位置、结构、性质的关系及应用,题目难度中等,正确推断各元素为解答本题的关键,注意熟悉掌握元素及其单质、化合物的性质,明确元素周期表结构、元素周期律的内容.

| A. | 6和8 | B. | 1和7 | C. | 11和16 | D. | 12和17 |
| A. | 颜色不同 | B. | 都能使滴有酚酞的NaOH溶液褪色 | ||
| C. | 都能使有色布条褪色 | D. | 加AgNO3溶液都能生成白色沉淀 |
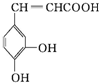
| A. | 该物质中苯环上一氯代物有2种 | |
| B. | 该分子结构中含有两种官能团 | |
| C. | 既能发生取代反应,也能发生加成反应 | |
| D. | 所有碳原子不可能都在同一个平面上 |
| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 含有共价键的物质一定是共价化合物 | |
| D. | 分子间作用力越大,分子的热稳定性就越大 |
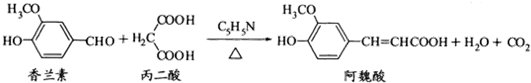
下列说法正确的是( )
| A. | 可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成 | |
| B. | 香兰素、阿魏酸均可与Na2CO3、NaOH、NaHCO3溶液反应 | |
| C. | 香兰素、阿魏酸都能发生取代、加成、消去反应 | |
| D. | 与香兰素互为同分异构体,分子中有4种不同化学环境的氢,且能发生银镜反应的酚类化合物共有2种 |
| 第一周期 |  | ||
| 第二周期 |  | 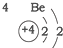 |  |
| 第三周期 | 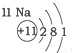 | 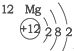 | 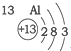 |
| A. | 元素所在的周期数等于其原子的电子层数 | |
| B. | 原子序数与元素原子核电荷数在数值上相同 | |
| C. | 第二、三周期元素的原子从左至右最外层电子数逐渐增多 | |
| D. | 金属元素的原子,其最外层电子数一般少于4个,在化学反应中易得到电子,趋向达到相对稳定结构 |
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
(1)同一周期中,从左到右,元素的电负性逐渐增大;同一主族中,从上到下,元素的电负性逐渐减小.所以,元素的电负性随原子序数的递增呈周期性变化.
(2)短周期元素中,由电负性最大的元素与电负性最小的元素形成的化合物的化学式为NaF,用电子式表示该化合物的形成过程:
 .
.(3)表中符合“对角线规则”的元素有Li和Na、Be和Mg、B和Al,它们的性质分别有一定的相似性,其原因是处对角线上,写出Be(OH)2与强酸及强碱反应的离子方程式:Be(OH)2+2OH-=BeO22-+2H2O;.
(4)一般认为,两成键元素间电负性差值大于1.7时形成离子键,两成键元素间电负性差值小于1.7时,形成共价键.判断Mg3N2、SO2、AlCl3、CS2、MgO是离子化合物还是共价化合物.
离子化合物Mg3N2、MgO、共价化合物SO2、AlCl3、CS2.