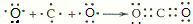题目内容
9.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:(1)若在一容积为2L的密闭容器中加入0.2molN2;的和0.6molH2的,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2mol.则前5分钟的平均反应速率v( N2)=0.01mol/(L•min).
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0
,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2 的大小,K1>K2 (填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是BC(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g) 的化学平衡常数为2.当测得NH3、N2
和H2 物质的量分别为3mol、2mol和1mol时,则该反应的v(N2)正>v(N2)逆(填“<”、“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
分析 (1)5min达平衡,△c(NH3)=0.1mol/L,根据v=$\frac{△c}{△t}$计算v(NH3),再根据反应速率之比等于系数之比计算v(N2);利用浓度变化量之比等于化学计量数之比,根据△c(NH3)计算△c(H2),再根据n=cV计算参加反应的氢气的物质的量,据此计算转化率.
(2)反应是气体体积减小的放热反应,平衡后,若要提高H2的转化率,改变条件需要平衡正向进行,但不能增大氢气的量;
(3)①对于放热反应,温度越高,平衡逆向移动,反应平衡常数越小;
②根据平衡状态的判断依据判断,N2(g)+3H2(g)?2NH3(g)△H<0,反应是气体体积减小的放热反应,则
A、反应过程中容器内各物质变化的浓度之比始终等于计量数之比,和起始量变化量有关;
B、不同物质的正逆反应速率之比等于其计量数之比是平衡状态;
C、反应前后气体物质的量变化,当容器内压强不变,气体的物质的量不变;
D、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,;
③化学平衡常数,正反应平衡常数和你反应的平衡常数互为倒数,根据浓度熵和平衡常数的关系来确定平衡的移动方向;
(4)化学反应速率是表示物质反应快慢的物理量,在一定条件下反应达到化学平衡状态时,正逆反应速率相等,各物质的浓度不变,化学平衡为动态平衡,当外界条件发生改变时,平衡发生移动,可通过改变外界条件是平衡发生移动,提高化工生产的综合经济效益.
解答 解:(1)5min达平衡,△c(NH3)=0.1mol/L,所以v(NH3)=$\frac{0.1mol/L}{5min}$=0.02mol/(L•min),根据反应速率之比等于系数之比,则v(N2)=$\frac{1}{2}$×0.02mol/(L•min)=0.01mol/(L•min);
故答案为:0.01mol/(L•min);
(2)A.催化剂不改变平衡移动,故A错误;
B.增大容器体积,相当于减小压强,平衡逆反应方向移动,故B错误;
C.反应为放热反应,降低温度,平衡向正反应移动,故C正确;
D.加入一定量N2,平衡向正反应方向移动,故D正确.
故选:CD;
(3)①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,故答案为:>;
②N2(g)+3H2(g)?2NH3(g)△H<0,反应是气体体积减小的放热反应,则
A、平衡浓度之比和起始量和变化量有关,容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故A错误;
B、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3υ(N2)(正)=υ(H2)(逆),说明氢气的正逆反应速率相同是平衡状态,故B正确;
C、反应前后气体物质的量变化,当容器内压强不变,气体的物质的量不变,该反应达平衡状态,故C正确;
D、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故D错误;
故答案为:BC;
③400℃时,反应2NH3(g)?N2(g)+3H2(g)的化学平衡常数K的值和反应N2(g)+3H2(g)?2NH3(g)的平衡常数呈倒数,所以K=$\frac{0.1mol/L}{5min}$=2;
容器的体积为0.5L,NH3和N2.H2的物质的量浓度分别为:6mol/L、4mol/L、2mol/L,400℃时,浓度商Qc=$\frac{2×{2}^{3}}{{6}^{2}}$=$\frac{8}{9}$<K=2,说明反应正向进行,因此有v(N2)正>v(N2)逆;
故答案为:2;>;
(4)A.根据影响化学反应速率的因素,可指导怎样在一定时间内快出产品,故A正确;
B.结合影响化学平衡的因素,采用合适的外界条件,是平衡向正反应方向移动,可提高产率,故B正确;
C.化学反应速率是表示物质反应的快慢,不能改变原料的转化率,故C错误;
D.在一定的反应速率的前提下,尽可能使平衡向正反应方向移动,可提高化工生产的综合经济效益,故D正确.
故选C.
点评 本题考查化学平衡常数及影响因素、意义,反应速率计算等,题目难度中等,注意化学平衡常数大小说明反应进行程度,与反应难易无关、与反应速率无关.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案| A. | Li、Be、B原子最外层电子数逐渐增多 | |
| B. | N、O、F原子半径依次增大 | |
| C. | Li、Na、K的金属性依次减弱 | |
| D. | P、S、Cl最高正价依次升高 |
| A. | ②③ | B. | ④⑥⑦ | C. | ①④⑥⑦ | D. | ②③⑤⑦ |
| A. | 11g | B. | 17g | C. | 44g | D. | 22g |
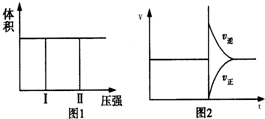
| A. | 若把2molX和1 molY充入该容器时,处于状 态Ⅰ,达到平衡时处于状态Ⅱ(如图1所示),则该反应的正反应是吸热反应 | |
| B. | 若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,Z的物质的量仍为 p mol,则W的起始物质的量n(W)应满足的条件是n(W)>(1-0.5p) mol | |
| C. | 反应达到平衡后,再将2molX和1 molY充入该容器中,则反应速率V与时间t关系图如图2所示 | |
| D. | 若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的密度未发生改变 |
| A. | 6和8 | B. | 1和7 | C. | 11和16 | D. | 12和17 |
| A. | 颜色不同 | B. | 都能使滴有酚酞的NaOH溶液褪色 | ||
| C. | 都能使有色布条褪色 | D. | 加AgNO3溶液都能生成白色沉淀 |
 写出B的氢化物的结构式:
写出B的氢化物的结构式: 用电子式表示A、C两元素形成AC2的过程:
用电子式表示A、C两元素形成AC2的过程: