题目内容
17.锌与100mL 18.5mol•L-1的硫酸充分反应后,锌完全溶解,同时生成气体甲 33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的C(H+)=0.1mol•L-1,下列叙述不正确的是( )| A. | 反应中共消耗1.8 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为4:1 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 反应中共转移3 mol电子 |
分析 Zn和浓硫酸发生:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,随着反应的进行,溶液浓度减小,
稀硫酸与Zn发生:Zn+H2SO4(稀)=ZnSO4+H2↑,则生成的气体为SO2和的H2混合物,根据反应的有关方程式结合质量守恒定律列方程组计算.
解答 解:生成气体的物质的量为$\frac{33.6L}{22.4/mol}$=1.5mol,溶液剩余硫酸的物质的量为$\frac{1}{2}$×1L×0.1mol/L=0.05mol,
参加反应的n(H2SO4)=0.1L×18.5mol/L-0.05mol=1.8mol,随着反应的进行,硫酸的浓度逐渐减小,
设反应生成xmolSO2,ymolH2,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=1.5
2x+y=1.8
解之得 x=0.3,y=1.2
所以反应会生成0.3mol的二氧化硫和1.2mol的氢气.
A.由以上计算可知,反应中共消耗1.8molH2SO4,故A正确;
B.气体A为SO2和H2的混合物,且V(SO2):V(H2)=1:4,故B错误;
C.反应中共消耗金属Zn的质量m(Zn)=(0.3mol+1.2mol)×65g/mol=97.5g,故C正确;
D.在反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O中,生成0.3mol的二氧化硫转移电子为0.6mol,反应Zn+H2SO4(稀)=ZnSO4+H2↑中,生成1.2mol氢气转移电子2.4mol,所以反应中共转移3mol电子,故D正确.
故选B.
点评 本题考查方程式的相关计算,侧重于学生的分析、计算能力的考查,题目难度不大,注意浓硫酸和稀硫酸性质的不同,从质量守恒的角度解答该题,计算生成气体的物质的量关系是解答该题的关键.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | 3和17 | B. | 1和8 | C. | 6和8 | D. | 7和12 |
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,A2+H2?2HA K=5.6×107 B2+H2?2HB K=43 | 非金属性:A>B |
| A. | A | B. | B | C. | C | D. | D |
| A. | F? | B. | Cl? | C. | NH3 | D. | Na+ |
| A. | 乙酸乙酯和水 | B. | 溴苯和水 | C. | 苯和甲苯 | D. | 硝基苯和水 |
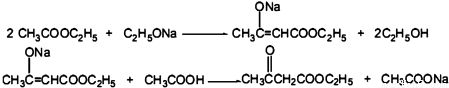

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.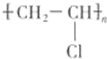 .
. ;
;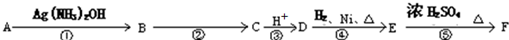
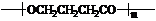 +nH2O.
+nH2O.