题目内容
5.下列事实不能说明元素的金属性或非金属性相对强弱的是( )| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,A2+H2?2HA K=5.6×107 B2+H2?2HB K=43 | 非金属性:A>B |
| A. | A | B. | B | C. | C | D. | D |
分析 A.金属性越强,与水反应越剧烈;
B.金属性越强,对应的最高价氧化物的水化物碱性越强;
C.SO2与NaHCO3溶液反应生成CO2,可知酸性亚硫酸大于碳酸;
D.K越大,说明生成的气态氢化物越稳定.
解答 解:A.N、Mg位于同周期,金属性Na>Mg,则与冷水反应,Na比Mg剧烈,故A正确;
B.Ca、Mg位于同主族,金属性Ca>Mg,对应的最高价氧化物的水化物碱性为Ca(OH)2强于Mg(OH)2,故B正确;
C.SO2与NaHCO3溶液反应生成CO2,可知酸性亚硫酸大于碳酸,亚硫酸不是最高价氧化物的水化物,则不能以此比较非金属性,故C错误;
D.K越大,说明生成的气态氢化物越稳定,则稳定性为HA>HB,则非金属性为A>B,故D正确;
故选C.
点评 本题考查金属性及非金属性的比较,把握元素的位置、元素周期律及比较方法为解答的关键,注意归纳金属性、非金属性比较方法,题目难度不大.

练习册系列答案
相关题目
13.根据下表中所列键能数据,判断下列分子中,最不稳定的分子是( )
| 化学键 | H-H | H-Cl | H-I | Cl-Cl | Br-Br |
| 键能/kJ/mol | 436 | 431 | 299 | 247 | 193 |
| A. | HCl | B. | HBr | C. | H2 | D. | Br2 |
10.按官能团分类,下列物质与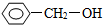 不同类的是( )
不同类的是( )
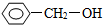 不同类的是( )
不同类的是( )| A. |  | B. |  | C. | CH3CH2OH | D. | HOCH3 |
17.锌与100mL 18.5mol•L-1的硫酸充分反应后,锌完全溶解,同时生成气体甲 33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的C(H+)=0.1mol•L-1,下列叙述不正确的是( )
| A. | 反应中共消耗1.8 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为4:1 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 反应中共转移3 mol电子 |
14.某有机物分子中含一个-C6H4-、一个-CH3和一个-OH,符合这种结构的酚类物质共有( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
15.2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国).下列关于Ds的说法不正确的是( )
| A. | Ds原子在周期表中位于第7周期第ⅦB族 | |
| B. | Ds是过渡元素 | |
| C. | Ds原子的核外电子数为110 | |
| D. | Ds为金属元素 |
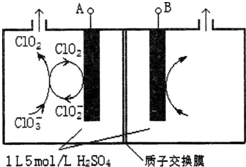 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.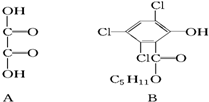 化合物A、B可合成荧光“魔棒”中产生能量的物质之一(CPPO).
化合物A、B可合成荧光“魔棒”中产生能量的物质之一(CPPO).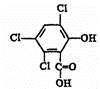 .
. .
. W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大.Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的调味品;X的简单气态氢化物水溶液呈碱性.请回答下列问题:
W、X、Y、Z、M、G六种主族元素分属三个短周期,且原子序数依次增大.Y是地壳中含量最多的元素;M与Y同主族;G与Z形成的化合物是厨房常用的调味品;X的简单气态氢化物水溶液呈碱性.请回答下列问题: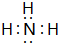 ,W、Y、Z、M、G形成的简单离子的半径大小顺序是S2->Cl->O2->Na+>H+(用相应的离子符号表示).
,W、Y、Z、M、G形成的简单离子的半径大小顺序是S2->Cl->O2->Na+>H+(用相应的离子符号表示).