题目内容
5.下列说法正确的是( )| A. | 离子半径大小:F->Na+>Mg2+ | B. | 金属性强弱:K>Mg>Ca | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:LiOH>NaOH>KOH? |
分析 A.核外电子排布相同时,原子序数越大,半径越小;
B.同主族,原子序数越大,金属性越强,同周期,原子序数越小,金属性越强;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.金属性越强,对应的最高价氧化物的水化物的碱性越强.
解答 解:A.核外电子排布相同时,原子序数越大,离子半径越小,则离子半径:Mg2+<Na+<F-,即F->Na+>Mg2+,故A正确;
B.Mg与Ca处于同一主族,金属性Ca>Mg,故金属性强弱为:K>Ca>Mg,故B错误;
C.元素的非金属性Cl>Br>I,对应的最高价氧化物的水化物的酸性HClO4>HBrO4>HIO4,故C错误;
D.金属性越强,对应的最高价氧化物的水化物的碱性越强,由于金属性K>Na>Li,故碱性KOH>NaOH>LiOH,故D错误;
故选A.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
15.对下列各图曲线表征的信息解毒错误的是( )
| A. | 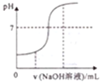 向酸性溶液中滴加NaOH溶液时pH随NaOH溶液体积变化关系 | |
| B. |  某反应为放热反应,催化剂能改变反应的焓变 | |
| C. |  不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. | 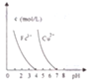 pH=7时,Cu2+、Fe3+都能沉淀完全 |
16.能够鉴定溴乙烷中存在溴元素的实验操作是( )
| A. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液 | |
| B. | 加入NaOH溶液加热,冷却后加入稀硝酸酸化,然后加入AgNO3溶液 | |
| C. | 在溴乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 |
13.根据图示装置,下列说法不正确的是( )
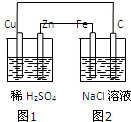

| A. | 装置中图1为原电池,图2为电解池 | |
| B. | 图2中Fe电极上的电极反应式为:2C1--2e一═C12↑ | |
| C. | 图1、图2溶液中的H+分别向Cu、Fe电极移动 | |
| D. | 该装置工作一段时间后,图1、图2溶液的pH均增大 |
17.下列物质属于纯净物的是( )
| A. | 葡萄糖 | B. | 聚乙烯 | C. | 医用酒精 | D. | 油脂 |
14.18O是一种示踪原子,用来探究反应历程.在密闭容器中加入CO和H218O发生反应CO+H218O═CO2+H2,一段时间后达到平衡,18O存在于下列哪些微粒中( )
| A. | 只存在于CO2中 | B. | 只存在于CO中 | ||
| C. | 存在于CO2和H2O中 | D. | 存在于CO、H2O和CO2中 |