题目内容
2.如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )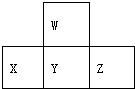
| A. | 元素X的最高价氧化物对应水化物的化学式为H3PO4 | |
| B. | 元素Y有2种氧化物且都能与元素W的氢化物反应生成对应价态的酸 | |
| C. | X、Y、Z各元素最高价和最低价的绝对值之和为8 | |
| D. | 原子半径的大小顺序是Z>Y>X>W |
分析 X原子最外层电子数比次外层电子数少3,推知X为P,根据W、Y、Z、X在周期表中的位置关系可知,W、Y、Z依次为O、S、Cl,根据元素周期律的递变规律判断元素的非金属性、原子半径以及对应化合物的性质.
解答 解:X原子最外层电子数比次外层电子数少3,推知X为P,则W、Y、Z依次为O、S、Cl,则
A.X为P,所以元素X的最高价氧化物对应水化物的化学式为H3PO4,故A正确;
B.Y为S,其氧化物有二氧化和三氧化硫,都能与水反应生成对应的酸,分别为亚硫酸和硫酸,故B正确;
C.X、Y、Z各元素最高正价分别为+5、+6、+7,最低负价以此为-3、-2、-1,化合价的绝对值的和均为8,故C正确;
D.同周期元素从左到右原子半径逐渐减小,同主族元素原子半径从上到下逐渐增大,则原子半径X>Y>Z>W,故D错误.
故选D.
点评 本题考查位置结构性质的相互关系应用,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意周期律的递变规律,本题易错点为D,注意分子中各原子最外层电子数的判断.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
13.根据图示装置,下列说法不正确的是( )
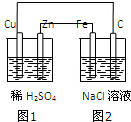

| A. | 装置中图1为原电池,图2为电解池 | |
| B. | 图2中Fe电极上的电极反应式为:2C1--2e一═C12↑ | |
| C. | 图1、图2溶液中的H+分别向Cu、Fe电极移动 | |
| D. | 该装置工作一段时间后,图1、图2溶液的pH均增大 |
17.下列物质属于纯净物的是( )
| A. | 葡萄糖 | B. | 聚乙烯 | C. | 医用酒精 | D. | 油脂 |
7.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则下列说法正确的是( )
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 甲、乙、丙的氧化物均为共价化合物 | |
| D. | 乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
14.18O是一种示踪原子,用来探究反应历程.在密闭容器中加入CO和H218O发生反应CO+H218O═CO2+H2,一段时间后达到平衡,18O存在于下列哪些微粒中( )
| A. | 只存在于CO2中 | B. | 只存在于CO中 | ||
| C. | 存在于CO2和H2O中 | D. | 存在于CO、H2O和CO2中 |
11.在汽车尾气排气管里装入三元催化剂,可发生如下反应以减小污染物排放:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)关于该可逆反应的下列说法中,不正确的是( )
| A. | 升高温度,正反应速率加快,逆反应速率减慢 | |
| B. | NO不可能全部转化为N2 | |
| C. | CO的转化率为最大值时,该反应达到平衡状态 | |
| D. | 单位时间内消耗NO和CO2的物质的量相等时,反应达到平衡状态 |
12.下列每组的三种物质中,两边的固体均用导线连接,插入中间的液体中,其中能组成原电池的是( )
| A. | Fe|H2SO4(稀)|石墨 | B. | Cu|H2SO4(稀)|Cu | C. | Cu|CCl4|Ag | D. | Zn|蔗糖溶液|Cu |
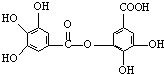 四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示:
四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如图所示: .
.