题目内容
7.下列各物质的转化关系如图所示,其中A是一种高熔点的两性氧化物固体,D是一种红棕色固体(俗称铁锈红)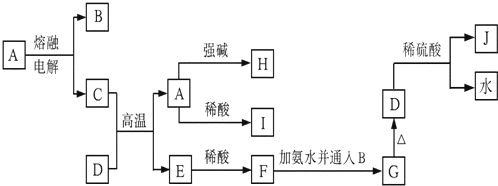
试分析推断,并回答下列问题:
(1)A的化学式为Al2O3 G的化学式为Fe(OH)3 J的化学式为Fe2(SO4)3
(2)写出C+D═A+E的化学反应方程式Fe2O3+2Al=2Fe+Al2O3
(3)若所加强碱是NaOH,写出由A与NaOH反应生成H的离子反应方程式:Al2O3+2OH-=2AlO2-+H2O
(4)若所加稀酸是盐酸,请写出由E生成F的离子方程式Fe+2H+=Fe2++H2↑
(5)写出由F生成G的现象生成的白色沉淀又变成灰绿色,最后变成红褐色沉淀.
分析 D是一种红棕色固体,则可知,D为Fe2O3;A是一种高熔点的两性氧化物固体,则为Al2O3,电解Al2O3时生成Al和O2,则C为Al,B为O2,E为Fe,H含有AlO2-,I含有Al3+,F含有Fe2+,G为Fe(OH)3,J为Fe2(SO4)3,结合物质的性质和题目要求可解答该题.
解答 解:D是一种红棕色固体,则可知,D为Fe2O3;A是一种高熔点的两性氧化物固体,则A为Al2O3,电解Al2O3时生成Al和O2,则C为Al,B为O2,E为Fe,H含有AlO2-,I含有Al3+,F含有Fe2+,G为Fe(OH)3,J为Fe2(SO4)3,
(1)根据上面的分析可知,A为Al2O3,G为Fe(OH)3,J为Fe2(SO4)3,
故答案为:Al2O3;Fe(OH)3;Fe2(SO4)3;
A的化学式为 G的化学式为 J的化学式为
(2)C+D═A+E的化学反应方程式为Fe 2O3+2 Al=2Fe+Al2O3,
故答案为:Fe 2O3+2 Al=2Fe+Al2O3;
(3)A为Al2O3,A与NaOH反应生成H的离子反应方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(4)E为Fe,E与盐酸反应生成F的离子方程式为Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
(5)在F中加氨水,先生成氢氧化亚铁白色沉淀,后白色沉淀被氧气氧化成红褐色的氢氧化铁,所以由F生成G的现象为生成的白色沉淀又变成灰绿色,最后变成红褐色沉淀,
故答案为:生成的白色沉淀又变成灰绿色,最后变成红褐色沉淀;
点评 本题是一道典型的无机框图推断题,题目难度中等,本题不仅考查对元素化合物基础知识的掌握,还主要考查学科内知识间的综合推理能力,答题时注意根据物质的颜色和反应的条件进行推断.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A. | 把一段打磨过的镁带放入少量冷水中 | |
| B. | 把Cl2通入FeCl2溶液中 | |
| C. | 把绿豆大的钾投入到水中 | |
| D. | 把溴水滴加到KI淀粉溶液中 |
| A. | CH2CH2--乙烯的结构简式 | B. | 乙醇的结构简式--C2H6O | ||
| C. | 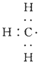 --甲基的电子式 --甲基的电子式 | D. | 四氯化碳的电子式为--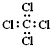 |
| A. | 氯水中有下列平衡Cl2+H2O?HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g),平衡体系增大压强可使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO△H<0,升高温度可使平衡向逆反应方向移动 | |
| D. | 合成NH3反应,为提高NH3的产率,理论上应采取降低温度的措施 |
| A. | ①AgNO3;②NaBr;③AgBr | B. | ①AgNO3;②NaCl;③AgCl | ||
| C. | ①AgCl; ②AgNO3;③NaCl | D. | ①AgNO3;②NaCl;③Ag |
| A. | 溴乙烷不溶于水,其密度比水的小 | |
| B. | 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 | |
| C. | 溴乙烷与NaOH的醇溶液混合共热可生成乙烯 | |
| D. | 溴乙烷通常用乙烷与液溴直接反应来制取 |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由X元素形成的单质不一定是原子晶体 | |
| D. | 由Y、Z、M三种元素形成的化合物一定只有共价键 |
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
| W | 灼烧其化合物时通过蓝色钴玻璃片观察火焰为紫色 |
元素Z的离子结构示意图为
 ,化合物WXY的电子式
,化合物WXY的电子式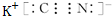 .
.(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.