题目内容
8.Ra(镭)是原子序数最大的第ⅡA族元素,下列说法不正确的是( )| A. | 原子半径是第ⅡA族中最大的 | B. | 遇冷水能剧烈反应 | ||
| C. | 位于第七周期 | D. | Ra(OH)2是两性氢氧化物 |
分析 A.同主族自上而下原子半径增大;
B.同主族自上而下,金属性增强,与水反应更剧烈;
C.Ra(镭)处于第七周期第ⅡA;
D.金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:Ra(镭)处于第七周期第ⅡA.
A.同主族自上而下原子半径增大,故Ra的原子半径是第ⅡA族中最大的,故A正确;
B.同主族自上而下,金属性增强,Ra是第ⅡA族中金属性最强的,遇冷水能剧烈反应,故B正确;
C.Ra(镭)处于第七周期第ⅡA,故C正确;
D.同主族自上而下,金属性增强,Ra是第ⅡA族中金属性最强的,Ra(OH)2是强碱,不是两性氢氧化物,故D错误,
故选D.
点评 本题考查同主族元素化合物性质递变规律,难度不大,注意对元素周期律的理解掌握,有利于基础知识的巩固.

练习册系列答案
相关题目
18.下列化学用语正确的是( )
| A. | CH2CH2--乙烯的结构简式 | B. | 乙醇的结构简式--C2H6O | ||
| C. | 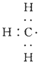 --甲基的电子式 --甲基的电子式 | D. | 四氯化碳的电子式为--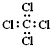 |
19.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由X元素形成的单质不一定是原子晶体 | |
| D. | 由Y、Z、M三种元素形成的化合物一定只有共价键 |
16.现有前20号的元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代:这种同位素的符号是146C(用元素符号表示)
元素Z的离子结构示意图为 ,化合物WXY的电子式
,化合物WXY的电子式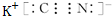 .
.
(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
| W | 灼烧其化合物时通过蓝色钴玻璃片观察火焰为紫色 |
元素Z的离子结构示意图为
 ,化合物WXY的电子式
,化合物WXY的电子式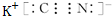 .
.(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态.
3.同周期的X、Y、Z三种元素,它们的气态氢化物的化学式分别为H2X、YH3、ZH4,下列说法正确的是( )
| A. | 气态氢化物的稳定性按X、Y、Z的顺序递增 | |
| B. | 三种元素的最高价氧化物对应的水化物酸性:H2ZO3>H3YO4>H2XO4 | |
| C. | 元素的最高正化合价按X、Y、Z的顺序递增 | |
| D. | 元素原子的半径按X、Y、Z的顺序递增 |
13.含有下列各组离子的溶液中,通入NH3后仍能大量共存的是( )
| A. | H+,Cu2+,Fe3+、SO4 2- | B. | Ba2+,Na+,Al3+、Cl- | ||
| C. | K+、Ag+ NH4+,NO3- | D. | Na+、K+、Br-、OH- |
18.在下列影响化学反应速率因素中,肯定能使化学反应速率加快的方法是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末.
①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末.
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有③④ | D. | ①②③④ |