题目内容
9. 如图为锌、铜、硫酸铜溶液构成的原电池,请写出负极、以及电池总反应.
如图为锌、铜、硫酸铜溶液构成的原电池,请写出负极、以及电池总反应.电子的流动方向是:从负极锌沿导线流向正极铜;
负极:Zn-2e-=Zn2+;
正极:Cu2++2e-=Cu;
电池的总反应:Cu2++Zn=Cu+Zn2+.
分析 铜、锌、硫酸铜溶液构成原电池中,易失电子的锌作负极,铜作正极,正极上得电子发生还原反应,正极和负极反应相加得到总反应,电子从负极沿导线流向正极,据此回答.
解答 解:铜、锌、硫酸铜溶液构成原电池中,易失电子的锌作负极,负极上锌失电子发生氧化反应,Zn-2e-=Zn2+,铜作正极,正极上得电子发生还原反应Cu2++2e-=Cu,总反应是Cu2++Zn=Cu+Zn2+,电子从负极锌沿导线流向正极铜,
故答案为:从负极锌沿导线流向正极铜;Zn-2e-=Zn2+;Cu2++2e-=Cu;Cu2++Zn=Cu+Zn2+.
点评 本题考查了原电池原理,明确正负极上得失电子及反应类型、电子流向即可分析解答,难度不大.

练习册系列答案
相关题目
17.下列实验中,不能观察到明显变化的是( )
| A. | 把一段打磨过的镁带放入少量冷水中 | |
| B. | 把Cl2通入FeCl2溶液中 | |
| C. | 把绿豆大的钾投入到水中 | |
| D. | 把溴水滴加到KI淀粉溶液中 |
4.某元素的原子序数为7,下列有关该元素的推断不正确的是( )
| A. | 它处在元素周期表中第二周期ⅤA族 | |
| B. | 它的最高正价为+5,负价为-3 | |
| C. | 它的最高价氧化物对应水化物是一种强酸 | |
| D. | 它的非金属性比磷弱比氧强 |
14.Y元素最高正价与最低负价的绝对值之差是4,Y元素与M元素形成化合物M2Y,并在水中电离出电子层结构相同的离子,该化合物是( )
| A. | KCl | B. | Na2S | C. | Na2O | D. | K2S |
1.下列各组中,每种物质都既有离子键又有共价键的是( )
| A. | NaOH H2SO4 (NH4)2SO4 | B. | MgO Na2SO4 HNO3 | ||
| C. | Na2O2 KOH Na3PO4 | D. | HCl Al2O3 MgCl2 |
18.下列化学用语正确的是( )
| A. | CH2CH2--乙烯的结构简式 | B. | 乙醇的结构简式--C2H6O | ||
| C. | 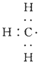 --甲基的电子式 --甲基的电子式 | D. | 四氯化碳的电子式为--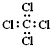 |
19.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由X元素形成的单质不一定是原子晶体 | |
| D. | 由Y、Z、M三种元素形成的化合物一定只有共价键 |
 实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2mol•L-1的盐酸进行滴定,完成下列问题:
实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2mol•L-1的盐酸进行滴定,完成下列问题:
 ,该反应的类型为酯化反应.
,该反应的类型为酯化反应.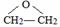 .
.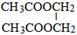 .
.