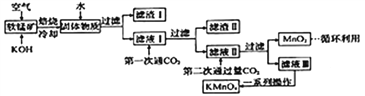
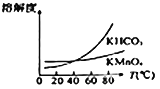
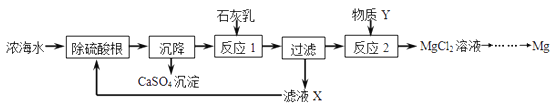
题目内容
【题目】下列化学用语正确的是 ( )
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. CaCO3的电离:CaCO3![]() Ca2++CO32-
Ca2++CO32-
C. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
D. Na2S溶液的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
【答案】C
【解析】A. HCO3-+H2O![]() H3O++CO32-是HCO3-的电离方程式,HCO3-的水解方程式为:HCO3-+H2O
H3O++CO32-是HCO3-的电离方程式,HCO3-的水解方程式为:HCO3-+H2O![]() OH-+H2CO3,故A错误;B. CaCO3是强电解质,正确的电离方程式为:CaCO3 = Ca2+ + CO32-,故B错误;C. 碳酸钙难溶于水,在水中存在溶解平衡:CaCO3(s)
OH-+H2CO3,故A错误;B. CaCO3是强电解质,正确的电离方程式为:CaCO3 = Ca2+ + CO32-,故B错误;C. 碳酸钙难溶于水,在水中存在溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq),故C正确;D. S2-水解分两步,正确的水解方程式为:S2-+H2O
Ca2+(aq)+CO32-(aq),故C正确;D. S2-水解分两步,正确的水解方程式为:S2-+H2O![]() HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O![]() H2S+OH-,故D错误;答案选C。
H2S+OH-,故D错误;答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】I. 常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸)或c(H+) | c(NaOH)/mol/L | 混合溶液的pH |
甲 | c(H+)=0.1 mol/L的HX酸 | 0.1 | pH=a |
乙 | c(HY)=0.1mol/L | 0.1 | pH=7 |
丙 | c(HZ)=0.1 mol/L | 0.1 | pH=9 |
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY溶液的pH=______。
(3)丙组实验发生反应的离子方程式为__________________,
所得溶液中由水电离出的c(OH-)=______mol/L。
II. 将0.1 mol·L-1 NaOH溶液分别滴入体积均为20 mL、浓度均为0.1 mol·L-1 HCl溶液和HA溶液,溶液的pH随加入NaOH溶液体积变化如图:
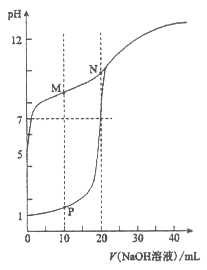
(1)HA为_______酸(填“强”或“弱”)。
(2)N点pH>7的原因是(用离子方程式表示)_________。
(3)下列说法正确的是_______ (填字母)。
a. M点c(HA)-)
b. M点c(Na+)>c(OH-)
c. P点c(Cl-)=0.05 mol·L-1
(4)NaA与NaOH等浓度等体积混合时,溶液中c(A-)______c(OH-)(填“<”,“=”或“>”)