题目内容
【题目】发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)![]() CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H_____(填“增大”、“减小”或“不变”)。
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中增大H2的浓度(其他条件保持不变),此反应的△H_____(填“增大”、“减小”或“不变”)。
(2)CO2制备甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。

①该反应化学平衡常数K的表达式是_________。
②0~9 min时间内,该反应的平均反应速率v(H2)=_________。
③在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是_________(填字母序号)kJ。
a. 0<Q<29.5 b. 29.5<Q<36.75
c. 36.75<Q<49 d. 49<Q<98
④在一定条件下,体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。
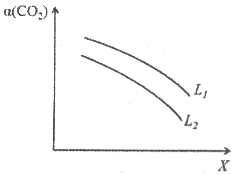
i. X表示的物理量是_________。
ii. 判断L1与L2的大小关系:L1________L2(填“<”,“=”或“>”),并简述理由:_________。
【答案】 不变 K=![]() 0.25 mol·L-1·min-1 c 温度 L1>L2 温度一定时,增大压强,CO2平衡转化率增大
0.25 mol·L-1·min-1 c 温度 L1>L2 温度一定时,增大压强,CO2平衡转化率增大
【解析】(1)反应的焓变至由方程式的系数和物质的状态决定,所以增大H2的浓度(其他条件保持不变),此反应的△H不变。
(2)①反应的平衡常数表达式为K=![]() 。
。
②![]() ,不同物质的速率比等于其系数比,所以
,不同物质的速率比等于其系数比,所以![]() 。
。
③在原来的1L容器中,达平衡的过程中,反应了0.75mol的CO2,所以放出的热为49×0.75=36.75kJ。其他条件不变,将容器体积改为0.5L,减小体积相当于增大压强,所以平衡正向移动,应该反应更多的CO2,所以放热大于36.75kJ;但是初始只加入1molCO2,这1molCO2不可能都反应,所以放热一定小于49kJ。选项c正确。
④ⅰ图中看出,随着X的升高,CO2的转化率降低。若X代表压强,增大压强,平衡正向移动,CO2的转化率升高,所以X不能代表压强。若X代表温度,升高温度,平衡逆向移动,CO2的转化率降低,所以X代表温度。
ⅱX代表温度,则L代表压强。其他条件不变,增大压强平衡正向移动,CO2的转化率升高,即CO2转化率越高,代表对应的压强越大,图中曲线L1对应的转化率更高,所以压强L1>L2。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案