题目内容
13.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
| A. | 该硫酸的物质的量浓度为9.2 mol/L | |
| B. | 1 mol Zn与足量该硫酸反应产生2 g氢气 | |
| C. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L |
分析 A.根据c=$\frac{1000ρω}{M}$计算该硫酸溶液的物质的量浓度;
B.锌与浓硫酸反应生成的是二氧化硫,不是氢气;
C.根据溶液稀释前后溶质的物质的量不变计算出需要浓硫酸的体积;
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,据此判断.
解答 解:A.该硫酸溶液的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B.锌在浓硫酸中反应生成SO2,不会生成氢气,故B错误;
C.溶液稀释前后溶质的物质的量不变,该浓硫酸浓度为18.4mol/L,配制200mL4.6mol/L的稀硫酸需取该硫酸体积=$\frac{4.6mol/L×0.2L}{18.4mol/L}$=0.05L=50mL,故C正确;
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,所得溶液的物质的量浓度小于9.2mol/L,故D错误.
故选C.
点评 本题考查浓硫酸的性质和物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度与溶质质量分数的关系,选项D易错点,注意硫酸的密度比水大,且浓度越大密度越答.

练习册系列答案
相关题目
4.化学来源于生活,也服务于生活,下列有关生活中的化学叙述正确的是( )
| A. | 冰箱中使用的含氟制冷剂泄露后,会增加空气中的PM2.5 | |
| B. | 节日焰火的五彩缤纷是某些金属单质性质的体现 | |
| C. | 施肥时,农家肥草木灰(有效成分K2CO3)不能与氮肥NH4Cl混合使用 | |
| D. | 化学反应能够制造出新的物质,同时也能制造出新的元素 |
8.将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
| A. | K+、OH-、Cl-、SO42- | B. | H+、NH4+、Al3+、NO3- | ||
| C. | Na+、S2-、Cl-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
18.下列有关化学用语表示正确的是( )
| A. | 二氧化碳分子的比例模型 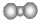 | |
| B. | 芳香烃的组成通式 CnH2n-6(n≥6) | |
| C. | 12C、14C原子结构示意图均可表示为 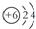 | |
| D. | 羟基的电子式 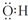 |
5.下列有关钢铁腐蚀与防护的说法错误的是( )
| A. | 生铁比纯铁容易生锈 | |
| B. | 钢铁的腐蚀生成疏松氧化膜,不能保护内层金属 | |
| C. | 钢铁发生吸氧腐蚀时,正极反应式为:O2+2H2O+4e→4OH- | |
| D. | 为保护地下钢管不受腐蚀,可使其与直流电源正极相连 |
3.化学在人类生活中扮演着重要角色,下列叙述正确的是( )
| A. | 氯处理饮用水时,在夏季的杀菌效果比在冬季好 | |
| B. | 利用化学反应可实现12C到14C的转化 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 气象环境报告中新增的“PM2.5”是对一种新分子的描述 |

 .
.
 .
.