题目内容
5. A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题.
A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题.(1)已知常温下A为有色气体.若F是一种金属单质,写出B和适量F反应生成C与气体E的离子方程式Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)若A为双原子分子,C为直线型分子,E具有漂白性,物质F焰色反应呈黄色.则F的化学式为Na2CO3.
(3)若A为淡黄色固体,则A与水反应的化学方程式为2 Na2O2+2H2O=4 NaOH+O2↑.
①若物质B和D的式量相等,D为淡黄色固体物质,C的大量排放往往会造成严重的环境问题即酸雨.C与F反应的化学方程式为2H2S+SO2=3S↓+2H2O;
②若物质A和D的式量相等,D为白色絮状沉淀,写出C与F反应的离子方程式Al3++3AlO2-+6H2O=4Al(OH)3↓.
分析 (1)已知常温下A为有色气体.若F是一种金属单质,由转化关系可知,F为变价金属,B具有强氧化性,则:A为二氧化氮,B为硝酸、E为NO,C为硝酸铁、D为硝酸亚铁;
(2)A为有色气体,与水反应生成B与E,E具有漂白性,则A为氯气、B为HCl、E为HClO,物质F焰色反应呈黄色,含有Na元素,C为直线型分子,结合转化关系可知,F为Na2CO3、C为CO2、D为NaHCO3;
(3)若A为淡黄色固体,能与水反应,则A为Na2O2.
①若物质B和D的式量相等,D为淡黄色固体物质,结合转化关系,B为氧气、F为硫化氢、C为二氧化硫、D为硫;
②若物质A和D的式量相等,D为白色絮状沉淀,结合转化关系,B为氢氧化钠、C为偏铝酸钠、F为铝盐、D为氢氧化铝、E为氧气.
解答 解:A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,由转化关系可知,B、E为短周期元素组成,
(1)常温下A为有色气体,若F是一种金属单质,由转化关系可知,F为变价金属,B具有强氧化性,则:A为二氧化氮,B为硝酸、E为NO,C为硝酸铁、D为硝酸亚铁,则B和适量F反应生成C与气体E的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O,
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)A为有色气体,与水反应生成B与E,E具有漂白性,则A为氯气、B为HCl、E为HClO,物质F焰色反应呈黄色,含有Na元素,C为直线型分子,结合转化关系可知,F为Na2CO3、C为CO2、D为NaHCO3,
故答案为:Na2CO3;
(2)A为淡黄色固体,能与水反应,则A为Na2O2,A与水反应的化学方程式为:2 Na2O2+2H2O=4 NaOH+O2↑,故答案为:2 Na2O2+2H2O=4 NaOH+O2↑;
①若物质B和D的式量相等,D为淡黄色固体物质,结合转化关系,B为氧气、F为硫化氢、C为二氧化硫、D为硫,则:二氧化硫的大量排放往往会造成酸雨,C与F反应的化学方程式为:2H2S+SO2=3S↓+2H2O,
故答案为:酸雨;2H2S+SO2=3S↓+2H2O;
②若物质A和D的式量相等,D为白色絮状沉淀,结合转化关系,B为氢氧化钠、C为偏铝酸钠、F为铝盐、D为氢氧化铝、E为氧气.C与F反应的离子方程式:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓.
点评 本题考查无机物推断,难度中等,熟练掌握元素化合物的性质是关键,侧重考查学生对常见物质性质与特殊反应考查.

| A. | 0.5 mol•L-1 CuCl2溶液中含有3.01×1023个Cu2+ | |
| B. | 标准状况下,2.24 L CO2气体含有1.81×1023个氧原子 | |
| C. | 48 g O3气体含有6.02×1023个O3分子 | |
| D. | 标准状况下,33.6 L H2O含有1.5NA个H2O分子 |
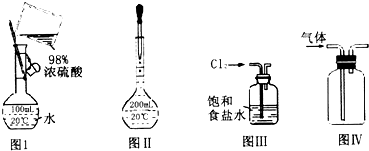
| A. | 图I表示为配制一定物质的量浓度稀硫酸时的操作 | |
| B. | 图Ⅱ表示为配制一定物质的量浓度的溶液定容时的操作 | |
| C. | 用图III所示装置吸收氯气中的氯化氢气体 | |
| D. | 用图IV所示装置收集一氧化氮气体 |
| A. | 为防止水污染,可用O3替代Cl2作饮用水消毒剂 | |
| B. | 实验室可用浓硫酸干燥SO2气体 | |
| C. | 16O和18O能形成三种化学性质相同的氧分子 | |
| D. | Al2(SO4)3,可除去碱性废水及酸性废水中的悬浮颗粒 |
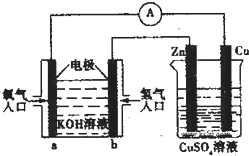
| A. | 一段时间后锌片质量减少 | |
| B. | 该装之中Cu极为正极 | |
| C. | b极的电极反应式:H2-2e-═2H+ | |
| D. | 当铜片的质量变化为12.8g时,a极上消耗的 O2在标况下的体积为2.24L |
| A. | 木炭在氧气中燃烧,产生大量白烟 | |
| B. | 红磷在空气中燃烧,产生苍白色火焰 | |
| C. | 镁条在空气中燃烧发出耀眼白光,生成黑色固体 | |
| D. | 硫在氧气中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体 |

 .
.