题目内容
15.将镁完全溶解于一定量浓硝酸反应,得到溶液A和NO2、N2O4、NO的混合气体,这些气体与2.24L O2(标准状况)混合后通入水中正好完全被水吸收,若向所得溶液A中加入NaOH溶液至恰好完全沉淀,将所得沉淀过滤洗涤灼烧至质量不再变化,此时固体量为( )| A. | 16g | B. | 8g | C. | 40g | D. | 0.2mol |
分析 向所得溶液中加入NaOH溶液至Mg2+恰好完全沉淀,沉淀为Mg(OH)2,沉淀过滤洗涤灼烧至质量不再变化,最终得到MgO,生成NO2、N2O4、NO 的混合气体与2.24L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Mg提供电子等于氧气获得的电子,再根据Mg原子守恒计算MgO物质的量,根据m=nM计算其质量.
解答 解:向所得溶液中加入NaOH溶液至Mg2+恰好完全沉淀,沉淀为Mg(OH)2,沉淀过滤洗涤灼烧至质量不再变化,最终得到MgO,生成NO2、N2O4、NO 的混合气体与2.24L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸,纵观整个过程,由电子转移守恒,可知Mg提供电子等于氧气获得的电子,氧气获得电子为:2.24L22.4L/mol2.24L22.4L/mol×4=0.4mol,故Mg的物质的量为0.4mol2=0.2mol,根据Mg原子守恒,可知MgO物质的量为0.2mol,故MgO质量为0.2mol×40g/mol=8g,故选BD.
点评 本题考查混合物计算,难度中等,侧重考查学生的分析思维能力与解题方法技巧,注意利用守恒法进行解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列排列顺序不正确的是( )
| A. | 离子半径:Cl->Mg2+>Na+ | B. | 热稳定性:HF>H2O>H2S | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 非金属性:Cl>Br>I |
3.萘的结构为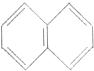 ,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
 ,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )
,若萘分子中有两个氢原子分别被溴原子取代,所形成的化合物的数目有( )| A. | 5种 | B. | 7种 | C. | 8种 | D. | 10种 |
10.下列反应能够瞬间完成的是( )
| A. | 硝酸与铜的反应 | B. | HNO3(aq)与NaOH(aq)的反应 | ||
| C. | 光照H2与O2的混合物 | D. | 铜绿的生成 |
8.有关化学用语的表示正确的是( )
| A. | 甲烷分子的比例模型是: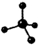 | B. | 二氧化碳的电子式: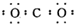 | ||
| C. | CO2的比例模型: | D. | HClO的结构式为:H-O-Cl |
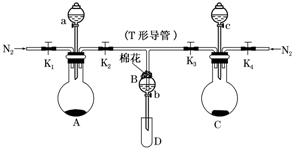 某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).
某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略). 目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.
目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.