题目内容
6.金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁).形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18.(1)金属羰基配合物中,微粒间作用力有b c(填字母代号)
a、离子键 b、共价键 c、配位键 d、金属键
(2)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃.由此推测,固体羰基铁更接近于分子晶体(填晶体类型).若用Fe(CO)x表示羰基铁的化学式,则x=5.
分析 (1)金属羰基配合物中应含有配位键,羰基中含有共价键;
(2)羰基铁沸点低,应为分子晶体,根据羰基铁中铁能提供的空轨道判断配位数.
解答 解:(1)金属羰基配合物中应含有配位键,羰基中含有共价键,
故答案为:bc;
(2)羰基铁沸点低,应为分子晶体,羰基铁中铁能提供的空轨道数为5,羰基铁的化学式为Fe(CO)5,
故答案为:分子晶体;5.
点评 本题考查配合物知识,题目难度不大,注意形成配位键的本质、配位数的确定方法,注意解答问题的方法的积累.

练习册系列答案
相关题目
17.用NA表示阿伏伽德罗常数的值,则下列叙述正确的是( )
| A. | 40gSiC晶体中含有2NA个Si-C共价键 | |
| B. | 标准状况下,22.4LCl2作为反应物参加反应时,转移的电子数一定为2NA | |
| C. | 1mol的CH≡CH中,所含σ键的总数为3NA | |
| D. | 常温常压下,100mL0.5mol/L的醋酸溶液中,醋酸根离子的数目为0.05NA |
14.根据下列各反应现象所归纳的元素性质不正确的是( )
| A. | 将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出.不能说明钠的金属性比铜弱 | |
| B. | 用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝.说明氯元素的非金属性比碘元素强 | |
| C. | 把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出.说明Cl的非金属性比S强 | |
| D. | 将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,除共同产生H2外,还分别生成了NaCl、MgCl2、AlCl3,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol.说明这三种金属的活泼性为:Al>Mg>Na |
1.下列说法正确的是( )
| A. | 乙烯、苯均能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醇和乙醛均能发生氧化反应生成乙酸 | |
| C. | 油脂水解的产物是氨基酸和甘油 | |
| D. | 淀粉和聚乙烯都是天然髙分子化合物 |
11.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
| A. | NaOH(s) | B. | CH3COONa(s) | C. | FeCl3(s) | D. | NH4Cl |
15.将镁完全溶解于一定量浓硝酸反应,得到溶液A和NO2、N2O4、NO的混合气体,这些气体与2.24L O2(标准状况)混合后通入水中正好完全被水吸收,若向所得溶液A中加入NaOH溶液至恰好完全沉淀,将所得沉淀过滤洗涤灼烧至质量不再变化,此时固体量为( )
| A. | 16g | B. | 8g | C. | 40g | D. | 0.2mol |
17.下列说法不正确的是( )
| A. | 乙烯、乙炔、溴苯分子中的所有原子均是共平面 | |
| B. | 乙烷(CH3CH3)和异丁烷( )互为同系物 )互为同系物 | |
| C. | 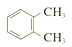 和 和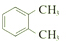 互为同分异构体 互为同分异构体 | |
| D. | 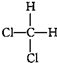 与 与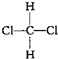 是同一种物质 是同一种物质 |