题目内容
10.一个原电池的总反应的离子方程式是Fe+Cu2+═Fe2++Cu,该反应的原电池组成正确的是( )| A | B | C | D | |
| 正极 | Fe | Fe | Cu | Cu |
| 负极 | Cu | Cu | Fe | Fe |
| 电解质溶液 | CuSO4 | H2SO4 | CuCl2 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
分析 由电池反应式Fe+Cu2+═Fe2++Cu知,Fe失电子发生氧化反应,作负极;不如Fe活泼的金属或导电的非金属作正极,正极上铜离子得电子发生还原反应,则电解质溶液中应含有铜离子,所以应为可溶性的铜盐,据此回答.
解答 解:由电池反应式Fe+Cu2+═Fe2++Cu知,Fe失电子发生氧化反应,作负极;不如Fe活泼的金属或导电的非金属作正极,正极上铜离子得电子发生还原反应,则电解质溶液中应含有铜离子,所以应为可溶性的铜盐,
A.Fe应作负极,可以是铜作正极,故A错误;
B.该装置中,Fe易失电子作负极,铜作正极,电解质溶液应为可溶性的铜盐,不符合条件,故B错误;
C.该装置中,Fe易失电子作负极,铜作正极,电解质溶液为可溶性的铜盐,符合条件,故C正确;
D.该装置不能自发的进行氧化还原反应,酒精是非电解质,故D错误;
故选C.
点评 本题考查了原电池原理,难度不大,明确原电池的构成条件是解本题关键,注意根据方程式中发生的反应类型判断原电池的正负极及电解质溶液.

练习册系列答案
相关题目
20.下列配合物的水溶液中加入硝酸银不能生成沉淀的是( )
| A. | [Co(NH3)4 Cl2]Cl | B. | [Cu(NH3)4]Cl2 | C. | [Co(NH3)6]Cl3 | D. | [Co(NH3)3 Cl3] |
1.在现代化学分析测试中,常借助一些仪器来分析化学物质的组成.下列有关说法不正确的是( )
| A. | 用红外光谱仪确定物质中是否存在Na+、K+、Cu2+等离子 | |
| B. | 用元素分析仪确定物质中是否含有C、H、O、N、S等 | |
| C. | 用原子吸收光谱确定物质中含有哪些金属元素 | |
| D. | 用pH计来测量溶液的酸碱性 |
5.一定温度下,1mol X和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.说法正确是( )
| A. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用M表示此反应速率是0.1 amol•(L•min)-1 | |
| C. | 用X表示此反应的反应速率是(0.1-0.2 a)mol•(L•min)-1 | |
| D. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 |
15.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ar,只有负化合价而无正价的元素是F,可用于制半导体材料的元素是Si.
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na;
(5)写出D的氢化物的电子式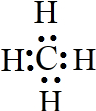 ;
;
(6)E、H的氢化物相互反应,产生白色固体,该固体中存在的化学键类型有离子键、共价键.
(7)用电子式表化合物BH的形成过程: .
.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
(2)最高价氧化物的水化物中碱性最强的是NaOH,酸性最强的是HClO4.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、J、E、F、G、H中,原子半径最大的是Na;
(5)写出D的氢化物的电子式
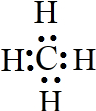 ;
;(6)E、H的氢化物相互反应,产生白色固体,该固体中存在的化学键类型有离子键、共价键.
(7)用电子式表化合物BH的形成过程:
 .
.  依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到). AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)
AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)