题目内容
3.短周期主族元素X、Y、Z的原子序数依次增大,在周期表中分处三个不同周期.X与Z同主族,X与Z的原子序数之和为12.下列说法中不正确的是( )| A. | 离子半径 Z>X | B. | 最外层电子数 Z>Y | ||
| C. | 金属性 Z>X | D. | 原子半径 Z>Y |
分析 短周期主族元素X、Y、Z的原子序数依次增大,在周期表中分处三个不同周期,则X、Y、Z分别处以一、二、三周期;X与Z同主族,则X只能为H元素、Z为Na元素,钠和氢元素的原子序数之和为12,满足X与Z的原子序数之和为12,据此进行解答.
解答 解:A.X为H元素、Z为Na元素,钠离子比氢离子多2个电子层,则钠离子半径大于氢离子,即:Z>X,故A正确;
B.钠的最外层只有1个电子,Y的最外层电子一定不小于1,则最外层电子数:Z≤Y,故B错误;
C.短周期元素中,Na的金属性最强,则金属性:Z>X,故C正确;
D.Z的电子层最多,则Z的原子半径最大,所以原子半径:Z>Y,故D正确;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,明确元素周期表结构、元素周期律内容为解答关键,注意掌握判断离子半径、原子半径大小的方法,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
8.25℃时,将0.02 mol•L-1的HCOOH溶液与0.01mol•L-1的NaOH溶液等体积混合,所得溶液的pH<7.则下列关系式中不正确的是( )
| A. | c(HCOO-)>c(Na+) | B. | c(HCOOH)<c(HCOO-) | ||
| C. | c(HCOOH)+c(HCOO-)=0.02mol•L-1 | D. | 2c(H+)+c(HCOOH)=c(HCOO-)+2c(OH-) |
11.下列分散系不能发生丁达尔现象的是( )
| A. | 豆浆 | B. | 烟 | C. | 蔗糖溶液 | D. | 云、雾 |
18.化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 合金材料中可能含有非金属元素 |
15.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(l)△H=-483.6 kJ•mol-1,则 2molH2(g)和1molO2(g)所含有的总能量比2mol H2O(l)所含有的总能量少483.6kJ | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 利用盖斯定律可以间接计算通过实验难以测定反应的反应热 |
12.碘在不同状态下(固态或气态)与氮气反应的热化学方程式如下所示:
①H2(g)+I2(?)?2HI(g)△H=+9.48kJ•mol-1
②H2(g)+I2(?)?2HI(g)△H=-26.48kJ•mol-1
下列刘断正确的是( )
①H2(g)+I2(?)?2HI(g)△H=+9.48kJ•mol-1
②H2(g)+I2(?)?2HI(g)△H=-26.48kJ•mol-1
下列刘断正确的是( )
| A. | ①中的为气态.②中的为固态 | |
| B. | ①的反应物总能量比②的反应物总能量低 | |
| C. | ①的产物比反应②的产物热稳定性更好 | |
| D. | 1mol固态碘升华时将吸热17kJ |
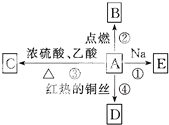 A是化学实验室中最常见的有机物,能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,能进行如图所示的多种反应. CH3COOCH2CH3+H2O;反应④2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
CH3COOCH2CH3+H2O;反应④2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
 (注明条件).
(注明条件). 、
、
 与1分子CH2=CHCOOCH2
与1分子CH2=CHCOOCH2 在一定条件下可发生类似反应①的反应,生成有机化合物W,W的结构简式为
在一定条件下可发生类似反应①的反应,生成有机化合物W,W的结构简式为 .
.