题目内容
13.A~I分别表示中学化学中常见的物质,它们之间的相互转化关系如图所示(部分反应物和生成物没有列出).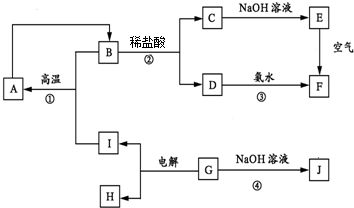
已知A、B、C、D、E、F六种物质中含有同一种元素,G为主族元素的固态氧化物.
(1)氢氧化钠的电子式为
 ,E的化学式为Fe(OH)2.
,E的化学式为Fe(OH)2.(2)①的化学方程式为8Al+3Fe3O4 $\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,该反应在工业中的一个用途是焊接钢轨.
(3)②的离子方程式是Fe3O4+8H+=Fe2++2Fe3++4H2O;该反应是否属于氧化还原反应?否(填“是”或“否”).理由是反应中各元素的化合价没有变化.
(4)③的离子方程式是Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+,④的离子方程式是Al2O3+2OH-=AlO2-+2H2O,.
分析 G为主族元素的固态氧化物且能与氢氧化钠反应以及能电解生成生成I和H,则G为Al2O3,与NaOH反应生成NaAlO2,则J为NaAlO2,G电解生成O2和Al,I和B在高温下生成A,A、B中含有同一种元素,B与盐酸反应生成C和D,C、D与碱反应生成E和F,E在空气中能转化成F,则可推知B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,Fe3O4与Al在高温下发生铝热反应生成A,A为Fe,根据物质的性质可进一步书写有关反应的化学方程式.
解答 解:G为主族元素的固态氧化物且能与氢氧化钠反应以及能电解生成生成I和H,则G为Al2O3,与NaOH反应生成NaAlO2,则J为NaAlO2,G电解生成O2和Al,I和B在高温下生成A,A、B中含有同一种元素,B与盐酸反应生成C和D,C、D与碱反应生成E和F,E在空气中能转化成F,则可推知B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,Fe3O4与Al在高温下发生铝热反应生成A,A为Fe,
(1)氢氧化钠的电子式为  ,根据上面的分析可知,E为Fe(OH)2,
,根据上面的分析可知,E为Fe(OH)2,
故答案为: ;Fe(OH)2;
;Fe(OH)2;
(2)①为Fe3O4与Al在高温下发生反应生成Fe与氧化铝,反应的方程式为:8Al+3Fe3O4 $\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,该反应在工业中的一个用途是焊接钢轨,
故答案为:8Al+3Fe3O4 $\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3;焊接钢轨;
(3)②的离子方程式是Fe3O4+8H+=Fe2++2Fe3++4H2O;该反应中各元素的化合价没有变化,所以不属于氧化还原反应,
故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;否;反应中各元素的化合价没有变化;
(4)反应③为氨水与氯化亚铁的反应,反应的离子方程式是Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+,反应④为氧化铝与氢氧化钠的反应,反应的离子方程式是Al2O3+2OH-=AlO2-+2H2O,
故答案为:Fe2++2NH3•H2O=Fe(OH)2↓+2NH4+;Al2O3+2OH-=AlO2-+2H2O.
点评 本题考查无机物的推断,涉及Fe、Al元素单质化合物性质,注意根据物质的性质和典型反应用逆推的方法推断,题目难度中等.

| A. | 通入大量 NO,ν 正、ν 逆 均增大 | |
| B. | 恒温恒容下充入 Ne,ν 正、ν 逆 均不变 | |
| C. | ν 正(NO)=2ν 逆(N2)时,反应达到平衡 | |
| D. | n (NO):n (CO):n (N2):n (CO2)=2:2:1:2 时,反应达到平衡 |

下列有关说法不正确的是( )
| A. | X试剂可用Na2SO3饱和溶液 | |
| B. | 步骤Ⅲ的离子反应:2Br-+Cl2═2Cl-+Br2 | |
| C. | 工业上每获得1molBr2,需要消耗Cl244.8L | |
| D. | 步骤Ⅳ包含萃取、分液和蒸馏 |
| A. | c(HCOO-)>c(Na+) | B. | c(HCOOH)<c(HCOO-) | ||
| C. | c(HCOOH)+c(HCOO-)=0.02mol•L-1 | D. | 2c(H+)+c(HCOOH)=c(HCOO-)+2c(OH-) |
| A. | 矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快 | |
| B. | 接触室中采用常压的主要原因是常压下SO2的转化率已经很高 | |
| C. | 沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒 | |
| D. | 接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量 |
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 3v逆(C)=2v正(B) | D. | 气体的平均相对分子质量 |
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红.
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为Mg(OH)2 .
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 氢气 |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤, 加入足量稀盐酸 | 产生气泡沉淀全部溶解 | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加 入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在④ CO32-离子 |
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中.实验前后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式Mg(OH)2(CO3)2或2MgCO3•Mg(OH)2 .
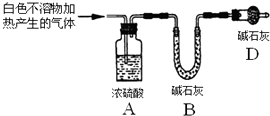
 .
.