题目内容
14. X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y的简单阴离子比W的简单阴离子还原性强 | |
| C. | Y与Z形成的化合物都可以和盐酸反应 | |
| D. | Q形成的含氧酸一定比W形成的含氧酸强 |
分析 均为短周期主族元素,其中W的单质是黄色固体,则W为S,由X、Y、W在周期表中的相对位置可知,Y为O元素,X为C碳元素,X、Y、Z、W、Q是原子序数依次增大,所以Q为Cl,其中只有Z是金属,则Z可能为Na、Mg、Al中的一种,然后结合元素的单质化合物的性质及元素周期律来解答.
解答 解:均为短周期主族元素,其中W的单质是黄色固体,则W为S,由X、Y、W在周期表中的相对位置可知,Y为O元素,X为C碳元素,X、Y、Z、W、Q是原子序数依次增大,所以Q为Cl,其中只有Z是金属,则Z可能为Na、Mg、Al中的一种.
A.同周期自左而右原子半径增大,电子层越多原子半径越大,故原子半径:Z>W>Q>X>Y,故A错误;
B.同主族自上而下元素非金属性减弱,非金属性越强,阴离子还原性越弱,故Y的简单阴离子比W的简单阴离子还原性弱,故B错误;
C.Y与Z形成的化合物可能为氧化钠、过氧化钠、氧化镁、氧化铝,均能与盐酸反应,故C正确;
D.Q形成含氧酸中次氯酸为弱酸,酸性比硫酸弱,故D错误,
故选C.
点评 本题考查位置结构性质关系应用,注意把握元素周期表和元素周期律,元素的推断是解答本题的关键,W为淡黄色固体为突破口,注意Z元素的不确定性,难度不大.

练习册系列答案
相关题目
4.现有室温下四种溶液,有关叙述不正确的是( )
| 编号 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④ | |
| B. | 分别加水稀释10倍,四种溶液的pH①>②>④>③ | |
| C. | ①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va :Vb=11:9 |
5.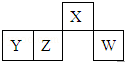 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
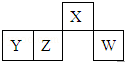 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | X的氢化物与氯化氢反应的产物溶于水形成的溶液呈酸性 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | 含Y元素的盐溶液一定显酸性 |
2.向AgNO3溶液中加入过量氨水,可生成[Ag(NH3)2]OH.下列说法正确的是( )
| A. | 氨气极易溶于水,所得的氨水中存在3种不同的氢键 | |
| B. | [Ag(NH3)2]+ 中含有6个σ键 | |
| C. | [Ag(NH3)2]OH所含有的化学键有离子键、极性共价键和配位键 | |
| D. | 在[Ag(NH3)2]+离子中Ag+给出孤对电子,NH3提供空轨道 |
9.元素周期表是化学学习的工具.如图是磷元素在周期表中的表示,下列有关磷元素的信息不正确的是( )

| A. | 原子序数是15 | B. | 它是非金属元素 | ||
| C. | 磷原子最外层有5个电子 | D. | 磷元素在地壳中的含量为30.97% |
6.下列说法正确的是( )
| A. | CH3CH2CH3分子中的3个碳原子不可能在同一直线上 | |
| B. | 油脂在酸性条件下的水解反应称为皂化反应 | |
| C. | 聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物 | |
| D. | CH3CH2OH与CH3CO18OH发生酯化反应所得混合液中,18O原子只存在于水分子中 |
10.哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下发生反应:N2+3H2?2NH3.下列有关说法不正确的是( )
| A. | 若2分钟达到化学平衡时N2还剩下0.4mol,则v(N2)=0.3mol/(L•min) | |
| B. | 达到化学平衡时,单位时间内每生成0.1mol的H2同时生成0.1mol的NH3 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡后,若增大压强使容器体积缩小,化学反应速率将会增大 |