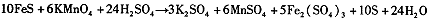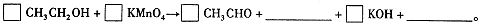题目内容
向盛有KI溶液的试管中加入少许CC14后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CC14层会逐渐变浅,最后变成无色。完成下列填空:
(1)上述过程CCl4层在试管中位于 (填上、下)层,分离CC14层和水层的操作名称是____ ,使用的玻璃仪器是 。
(2)写出并配平CC14层由紫色变成无色的化学反应方程式(如果系数是l不用填写);
+ + → HIO3+
(3)把KI换成KBr。则CC14层变为 色,该反应的离子方程式为 。继续滴加氯水,CCl4层的颜色没有变化。Cl2、 HIO3、HBrO3氧化性由强到弱的顺序是 。
(1)下 分液 分液漏斗、烧杯
(2)5Cl2+I2+6H2O=2HIO3+10HCl
(3)橙 Cl2+2Br-=2Cl-+Br2 HBrO3 > Cl2 >HIO3
解析试题分析:
(1)氯气置换出碘单质,在下层。不互溶的体系用分液的方法,需要分液漏斗和烧杯。
(2)根据电子转移守恒,元素守恒来配平。
(3)置换出的溴单质为橙色,由题干信息可知HBrO3>Cl2> HIO3。
考点:本题考查了氧化还原反应方程式的配平,氧化性强弱判断。

(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO  Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。
Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。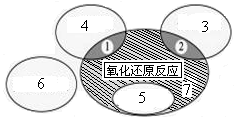
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.Zn+H2SO4=ZnSO4+H2↑ |
D.CuO+CO Cu+CO2 Cu+CO2 |
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知:该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中,发生还原反应的物质是 。
②写出该反应的化学方程式(不用配平)
_________+________ → ________+________+________
(3)3Cl2+8NH3
 N2+6NH4Cl
N2+6NH4Cl①用双线法表示该反应转移的电子数目和方向。
②该反应中,氧化剂与还原剂分子个数之比为 。
(4)在一定条件下,PbO2与Cr3+反应,产物是Cr2O72—和Pb2+。若与1molCr3+完全反应所需PbO2的物质的量为 。
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2 ↑(未配平)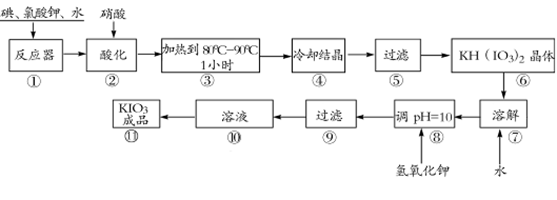
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:______________________________________________________________;
(2)步骤②中,用稀酸酸化的作用是____________________________________________;
不选稀盐酸的原因是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
Ⅰ.卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性
质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 | 现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
请回答:
(1)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(2)若用y表示锥形瓶中含碘物质的物质的量 ,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。

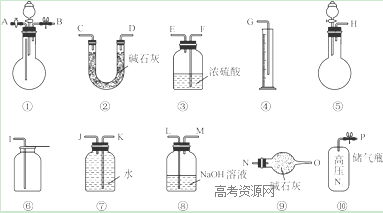
Ⅱ.过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序:
甲同学:⑤—⑧—③—⑦—④; 乙同学:⑤—③—②。
已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O。
(1)甲同学想通过实验测得的数据是____________,他选用的装置________(填序号)是没有必要的。
(2)乙同学想通过实验测得的数据是________________。有人认为按他测得的数据计算出的实验结果可能偏高,原因是________________; 为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用):________________(填序号)。
(10分)某研究性学习小组同学向Fe(NO3)3溶液中滴加淀粉KI溶液后,溶液呈蓝色。他们对Fe(NO3)3溶液中将I-氧化的氧化剂进行了如下探究:
【实验】分别向FeCl3溶液和HNO3溶液中滴加淀粉KI溶液后,发现溶液均显蓝色。
(1)FeCl3溶液与KI溶液反应的离子方程式为 。
(2)KI与HNO3反应的离子方程式为I-+H++NO3-→NO↑+I2+H2O(未配平),反应中氧化剂与还原剂的物质的量之比为 。
【提出假设】假设1:氧化剂只有Fe3+ 假设2:氧化剂只有NO3-(H+)
【设计实验方案,验证假设】
(3)请设计实验验证上述假设
供选试剂:0.2mol?L-1的Fe(NO3)3溶液、0.2mol?L-1的KI溶液、0.01mol?L-1的KMnO4酸性溶液、0.01mol?L-1的KSCN溶液、CCl4溶液、淀粉溶液。(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)
| 实验步骤 | 预期现象和结论 |
| ①取5ml0.2mol?L-1的Fe(NO3)3溶液和5ml0.2mol?L-1的KI溶液,充分反应后加入5ml CCl4溶液,振荡静置,取上层溶液,分置于A、B两支试管中 | |
| ② ③ | 若溶液不变红色,则假设1成立,否则假设1不成立; 若溶液显紫色,则假设2成立,否则假设2不成立 |
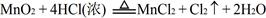 ,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。
,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是: 。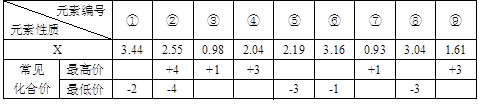
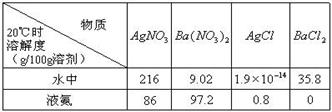
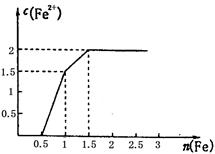
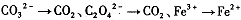 ,找出其中一个变化与“
,找出其中一个变化与“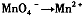 ”组成一个反应,写出该反应的离子方程式____ 。
”组成一个反应,写出该反应的离子方程式____ 。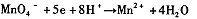
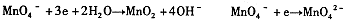 由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。
由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。