题目内容
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O--KH(IO3)2+KCl+Cl2 ↑(未配平)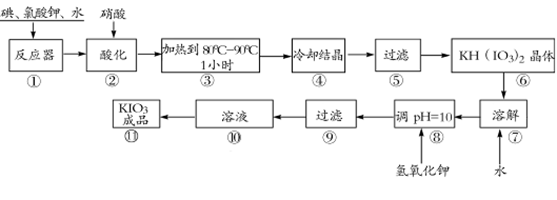
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:______________________________________________________________;
(2)步骤②中,用稀酸酸化的作用是____________________________________________;
不选稀盐酸的原因是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
(1)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑ (2分)
(2)促进氯气从反应混合物中逸出。(2分)盐酸能还原已生成的碘酸氢钾(2分)
(3)Cl2能将KIO3氧化成KIO4 (2分) (4)蒸发浓缩 冷却结晶 (2分)
解析试题分析:(1)反应I2→KH(IO3)2中,I元素化合价由0价升高为+5价,共升高10价。KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2。KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低共60价,故I2系数为6,根据氯原子守恒可知KClO3系数为11,根据碘原子守恒可知KH(IO3)2的系数为6,根据氢原子守恒可知H2O、系数为3,检查氧原子守恒,故方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑。(2)由信息可知,碘酸钾能被氯气氧化,由工艺流程可知酸化的目的是将氯气从反应混合物中逸出。酸性条件下碘酸钾是一种较强的氧化剂,盐酸能还原已生成的碘酸氢钾,所以不能使用稀盐酸。
(3)由信息可知,碘酸钾能被氯气氧化为高碘酸钾,所以要将氯气完全排出,防止碘酸钾被氧化。
(4)由表中数据可知温度越高,KIO3溶解度越大,所以从溶液中获得KIO3晶体的实验方法是蒸发浓缩、 冷却结晶。
考点:考查物质制备的实验设计与探究以及氧化还原反应的有关判断和方程式的配平

为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe NaNO2
NaNO2 5NaOH → 3Na2FeO2
5NaOH → 3Na2FeO2 H2O
H2O NH3↑
NH3↑
② Na2FeO2 NaNO2
NaNO2 H2O → Na2Fe2O4
H2O → Na2Fe2O4 NH3↑
NH3↑ NaOH
NaOH
③Na2FeO2 Na2Fe2O4
Na2Fe2O4 2H2O
2H2O Fe3O4
Fe3O4 4NaOH
4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,被还原的是 。若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是…………………………………………( )
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
某化学兴趣小组在探究卤素单质的氧化性的实验中发现,在足量的氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色,原因是什么?Br2能否氧化Fe2+,Fe3+与Br2谁的氧化性更强?
(1)甲同学认为:Br2不能氧化Fe2+,Fe3+的氧化性大于Br2,产生上述现象的原因不是化学反应所致,溶液呈黄色是含 (填化学式,下同)所致。
(2)乙同学认为:Br2将Fe2+氧化为Fe3+,Fe3+的氧化性小于Br2,产生上述现象的原因是化学反应所致,则溶液呈黄色是含 所致。
(3)丙同学为验证乙同学的观点,选择下列试剂,设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的,供选用的试剂:a.酚酞试剂;b.CCl4;c.无水酒精;d.KSCN溶液。请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 |
| 方案1 | |
| 方案2 | |
(4)氧化性:Br2>Fe3+,故在FeCl2中滴入1~2滴溴水,溶液呈黄色。发生反应的离子方程式是 。
(5)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 。在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有
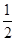 的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。
的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是 。 
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O