题目内容
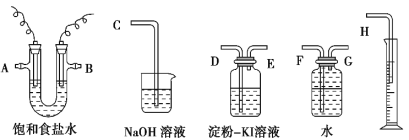
【题目】某实验小组用100 mL 0.50 mol·L-1 NaOH溶液与100 mL 0.55 mol·L-1盐酸进行中和热的测定。装置如图所示。回答下列问题:
(1)若实验共需要400 mL NaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体______g。
(2)图中装置缺少的仪器是______________________________。
(3)盐酸稍过量的原因是________________________________。
(4)碎泡沫塑料及泡沫塑料板的作用是___________________。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)________(填“偏大”“偏小”或“不变”),其原因是_______。
(6)请填写下表中的平均温度差:
实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | |||
HCl | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | ||
3 | 25.9 | 25.9 | 25.9 | 29.8 | ||
4 | 26.4 | 26.2 | 26.3 | 30.4 | ||
(7)若测得该反应放出的热量为2.865 kJ,请写出盐酸与NaOH溶液反应的中和热的方程式:__________________________________________。
【答案】10.0环形玻璃搅拌棒让NaOH溶液完全反应保温、隔热,减少热量损失偏大醋酸在溶液中电离吸收热量,使测得的中和热(ΔH)偏大4.0HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
【解析】
(1)因为没有400 mL容量瓶,实际配制的是500 mL(0.5 L)溶液,即m(NaOH)=0.50 mol·L-1×0.5 L×40 g/mol=10.0 g;(2)为减少热量损失,需缩短反应时间,要搅拌,应用环形玻璃搅拌棒;(3)为确保NaOH完全反应,减少误差,盐酸需要过量,故答案为让NaOH完全反应;(4)它们的作用都是保温,隔热、减少热量损失;(5)因为醋酸电离会吸热,所以用醋酸测中和热,放出的热量比盐酸要少,ΔH偏大,故答案为:偏大、醋酸在溶液中电离吸收热量,使测得的中和热(ΔH)偏大;(6)四组数据计算的温差分别为4.0 ℃、6.1 ℃、3.9 ℃、4.1 ℃,明显第2组数据应舍去,所以平均温度差为4.0 ℃;(7)在该中和实验中,生成水的物质的量为0.05mol,放出的热量为2.865 kJ,则生成1mol水放出的热量为2.865kJ÷0.05mol=57.3 J·mol-1,则ΔH=-57.3 kJ·mol-1,故反应的中和热化学方程式为HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1。

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案