题目内容
【题目】氰基烯酸酯在碱性条件下能快速聚合为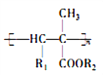 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
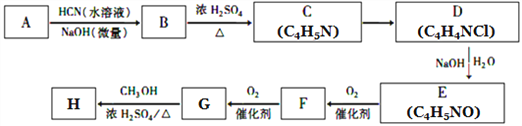
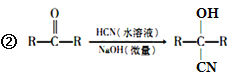
已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;
回答下列问题:
(1)A的化学名称为____________。
(2)C的结构简式为________________,F中的含氧官能团名称是________________。
(3)由E生成F的反应类型为_____________,由G生成H的反应类型为_____________。
(4)由G生成H的化学方程式为________________________________。
(5)写出A的能够发生银镜反应的同分异构体的结构简式______________。
【答案】 丙酮 ![]() 醛基 氧化反应 取代反应(酯化反应)
醛基 氧化反应 取代反应(酯化反应) ![]() + CH3OH
+ CH3OH ![]()
![]() + H2O CH3CH2CHO
+ H2O CH3CH2CHO
【解析】试题分析:(1)A的相对分子量为58,氧元素质量分数为0.276,则氧原子个数是58×0.276÷16=1,再根据商余法42÷12=3…6,A的分子式是C3H6O,核磁共振氢谱显示为单峰,A是CH3COCH3;(2)A是CH3COCH3,根据信息②,可知B是![]() ;B在浓硫酸作用下生成C,根据C的分子式C4H5N,可知C是
;B在浓硫酸作用下生成C,根据C的分子式C4H5N,可知C是![]() ;H是氰基丙烯酸酯,结合G在浓硫酸条件下与甲醇反应生成H,则H是
;H是氰基丙烯酸酯,结合G在浓硫酸条件下与甲醇反应生成H,则H是![]() ;逆推G是
;逆推G是![]() ;F是
;F是![]() ;E是
;E是![]() ;D是
;D是![]() 。
。
解析:根据以上分析,(1)A是CH3COCH3,化学名称为丙酮。
(2)C的结构简式为![]() ,F是
,F是![]() 含氧官能团是-CHO,名称是醛基。
含氧官能团是-CHO,名称是醛基。
(3)由![]() →
→![]() 的反应类型为氧化反应,
的反应类型为氧化反应,![]() 在浓硫酸条件下与甲醇反应生成
在浓硫酸条件下与甲醇反应生成![]() 的反应类型为酯化反应。
的反应类型为酯化反应。
(4)![]() 在浓硫酸条件下与甲醇反应生成
在浓硫酸条件下与甲醇反应生成![]() 的反应方程式为
的反应方程式为![]() + CH3OH
+ CH3OH ![]()
![]() + H2O。
+ H2O。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
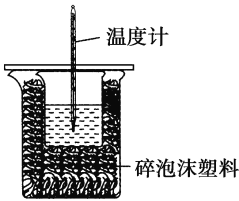
一课一练课时达标系列答案【题目】某实验小组用100 mL 0.50 mol·L-1 NaOH溶液与100 mL 0.55 mol·L-1盐酸进行中和热的测定。装置如图所示。回答下列问题:
(1)若实验共需要400 mL NaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体______g。
(2)图中装置缺少的仪器是______________________________。
(3)盐酸稍过量的原因是________________________________。
(4)碎泡沫塑料及泡沫塑料板的作用是___________________。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)________(填“偏大”“偏小”或“不变”),其原因是_______。
(6)请填写下表中的平均温度差:
实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | |||
HCl | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | ||
3 | 25.9 | 25.9 | 25.9 | 29.8 | ||
4 | 26.4 | 26.2 | 26.3 | 30.4 | ||
(7)若测得该反应放出的热量为2.865 kJ,请写出盐酸与NaOH溶液反应的中和热的方程式:__________________________________________。


