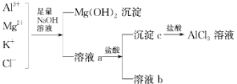
题目内容
【题目】盐酸、醋酸和氨水是中学化学中常见的三种物质,某校实验小组利用浓盐酸、冰醋酸和浓氨水分别配制了浓度均为0.1 mol·L-1的三种溶液各100 mL并进行相关实验,据此回答下列问题:
(1)常温下上述三种溶液的PH由大到小的顺序是____________________。
(2)25℃时,利用pH试纸测得0.1 mol·L-1醋酸溶液的pH约为5,则可以估算出醋酸的电离常数约为__________________;向10 mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中![]() 的值将_________(填“增大”“减小”或“无法确定”)。
的值将_________(填“增大”“减小”或“无法确定”)。
(3)将浓度均为0.1 mol·L-1的盐酸和氨水等体积混合,则:①所得混合溶液显_______性(填“酸性”“碱性”或“中性”),原因是__________________(用离子方程式表示)。
②所得混合溶液中所有离子的物质的量浓度由大到小的顺序为______。
【答案】 氨水>醋酸》盐酸 10-9 减小 酸性 NH4++H2O NH3.H2O+H+ c(Cl+)>c(NH4+)>c(H+)>c(OH-)
【解析】(1)0.1 mol·L-1氨水、醋酸、盐酸三种溶液,氨水是碱,pH最大,盐酸是强酸,pH最小,在常温下三种溶液的PH由大到小的顺序是:氨水>醋酸>盐酸;(2)25℃时,利用pH试纸测得0.1 mol·L-1醋酸溶液的pH约为5,则可以估算出醋酸的电离常数约为ka=c(H+)c(CH3COO-)/c(CH3COOH)=(10-5)2/0.1=10-9;向10 mL此溶液中加入少量冰醋酸,c(CH3COO-)增大,平衡常数不变,溶液中![]() =ka/c(CH3COO-)的值将减小。(3)将浓度均为0.1 mol·L-1的盐酸和氨水等体积混合,生成氯化铵溶液,则:①所得混合溶液显酸性性,原因是铵根离子水解,NH4++H2O NH3·H2O+H+ 。②氯化铵溶液中,铵根离子水解后溶液呈酸性,所得混合溶液中所有离子的物质的量浓度由大到小的顺序为 c(Cl+)>c(NH4+)>c(H+)>c(OH-)。
=ka/c(CH3COO-)的值将减小。(3)将浓度均为0.1 mol·L-1的盐酸和氨水等体积混合,生成氯化铵溶液,则:①所得混合溶液显酸性性,原因是铵根离子水解,NH4++H2O NH3·H2O+H+ 。②氯化铵溶液中,铵根离子水解后溶液呈酸性,所得混合溶液中所有离子的物质的量浓度由大到小的顺序为 c(Cl+)>c(NH4+)>c(H+)>c(OH-)。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
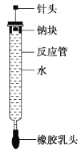
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】某实验小组用100 mL 0.50 mol·L-1 NaOH溶液与100 mL 0.55 mol·L-1盐酸进行中和热的测定。装置如图所示。回答下列问题:
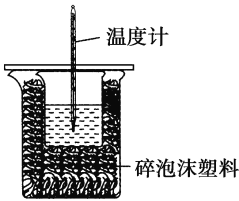
(1)若实验共需要400 mL NaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体______g。
(2)图中装置缺少的仪器是______________________________。
(3)盐酸稍过量的原因是________________________________。
(4)碎泡沫塑料及泡沫塑料板的作用是___________________。
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热(ΔH)________(填“偏大”“偏小”或“不变”),其原因是_______。
(6)请填写下表中的平均温度差:
实验次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | |||
HCl | NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ________ | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | ||
3 | 25.9 | 25.9 | 25.9 | 29.8 | ||
4 | 26.4 | 26.2 | 26.3 | 30.4 | ||
(7)若测得该反应放出的热量为2.865 kJ,请写出盐酸与NaOH溶液反应的中和热的方程式:__________________________________________。
【题目】(1)Br位于元素周期表第_____周期第_____族;基态Na+核外有_____种运动状态不同的电子;Mg基态原子核外电子排布式为_____。
(2)用“>”或“<”填空:
第一电离能 | 粒子半径 | 熔点 | 键的极性 |
N_____S | S2—_____ Mg2+ | SO3______Na2O2 | H﹣O_____H﹣N |
(3)已知多硫化钠﹣溴储能电池是一种二次电池,结构如图。电池总反应为:2Na2S3+2NaBr![]() 3Na2S2+Br2。
3Na2S2+Br2。
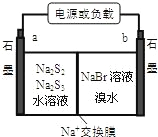
①放电时Na+向_____极迁移(填“a 或 b”);
②充电时阴极电极反应式为:______________。
(4)已知N4为正四面体结构,N﹣N键能为167kJ/mol,N≡N 键能为 942kJ/mol。写 出N4(g)转化为N2(g)的热化学方程式________________。