题目内容
【题目】回答下列问题:
(1)将等质量的镁分别与足量的CO2、O2、N2、空气中充分燃烧,反应前后固体增重由大到小的顺序为___。
(2)在常温下,实验室用固体亚硫酸钠和中等浓度的硫酸制取SO2气体。将制得的SO2气体通入紫色石蕊试液,可观察到的现象为___。
(3)在常温下,把NO气体压缩到1.01×108Pa,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力![]() 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___。
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___。
(4)按如图进行实验,试管中装有NO,然后缓慢地通入84mLO2,充分反应后液面高度不变,则原试管中装有NO的体积为___。
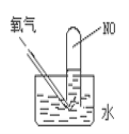
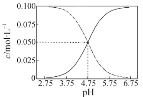
(5)标况下,将一定体积的盛满NO、NO2、O2的混合气体的试管倒立于水槽中,水充满整个试管,则试管内的溶液的物质的量浓度范围是(假定试管内溶液不扩散)为___。
【答案】CO2>O2>空气>N2 溶液变红 3NO=N2O+NO2 48mL 0.0357>c(HNO3)>0.0255或![]() >c(HNO3)>
>c(HNO3)>![]()
【解析】
(1)根据镁在氧气、氮气、二氧化碳中燃烧的方程式计算燃烧后固体的质量;
(2)二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的氢离子,所以溶液显酸性;
(3)若NO转化为N2O和O2,则气体的压强下降至原来的![]() ,不符合题意;若NO转化为N2O和NO2,少量NO2转化为N2O4,则气体的压强下降至略小于原来的
,不符合题意;若NO转化为N2O和NO2,少量NO2转化为N2O4,则气体的压强下降至略小于原来的 ![]() ,符合题意;
,符合题意;
(4)试管中装有NO的体积为xmL,然后缓慢地通入84mLO2,充分反应后液面高度不变,则剩下氧气为xmL,由阿伏伽德罗定律可知,体积之比等于物质的量之比,可计算;
(5)标况下,将一定体积的盛满NO、NO2、O2的混合气体的试管倒立于水槽中,水充满整个试管,可知三者要完全反应,反生的反应为:4NO+3O2+2H2O=4HNO3和4NO2+O2+2H2O=4HNO3,设试管体积为vL,采用一边倒计算。
(1) 2Mg+O2![]() 2MgO、N2+3Mg
2MgO、N2+3Mg![]() Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2![]() 2MgO+C,24g镁与O2反应生成1 mol MgO,质量增加16 g;24g镁与N2反应生成
2MgO+C,24g镁与O2反应生成1 mol MgO,质量增加16 g;24g镁与N2反应生成![]() mol Mg3N2,质量增加
mol Mg3N2,质量增加![]() g;24g镁与CO2反应生成1 mol MgO和
g;24g镁与CO2反应生成1 mol MgO和![]() mol C,质量增加22 g,空气的主要成分为氧气和氮气,质量增加介于两者之间,反应前后固体增重由大到小的顺序为CO2>O2>空气>N2,故答案为:CO2>O2>空气>N2;
mol C,质量增加22 g,空气的主要成分为氧气和氮气,质量增加介于两者之间,反应前后固体增重由大到小的顺序为CO2>O2>空气>N2,故答案为:CO2>O2>空气>N2;
(2)二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的氢离子,所以溶液显酸性,紫色石蕊试液遇酸变红色,继续通入过量SO2 气体,溶液的红色不会褪去,故答案为:溶液变红;
(3)若NO转化为N2O和O2,则气体的压强下降至原来的![]() ,不符合题意;若NO转化为N2O和NO2,少量NO2转化为N2O4,则气体的压强下降至略小于原来的
,不符合题意;若NO转化为N2O和NO2,少量NO2转化为N2O4,则气体的压强下降至略小于原来的 ![]() ,符合题意,所以上述变化的化学方程式:3NO=N2O+NO2,故答案为:3NO=N2O+NO2;
,符合题意,所以上述变化的化学方程式:3NO=N2O+NO2,故答案为:3NO=N2O+NO2;
(4)试管中装有NO的体积为xmL,然后缓慢地通入84mLO2,充分反应后液面高度不变,则剩下氧气为xmL,由阿伏伽德罗定律可知,体积之比等于物质的量之比,根据4NO+3O2+2H2O=4HNO3可得,消耗xmL的NO,会消耗氧气![]() ,则有
,则有![]() +x=84,解得x=48,则原试管中装有NO的体积为48mL,故答案为:48mL;
+x=84,解得x=48,则原试管中装有NO的体积为48mL,故答案为:48mL;
(5)标况下,将一定体积的盛满NO、NO2、O2的混合气体的试管倒立于水槽中,水充满整个试管,可知三者要完全反应,反生的反应为:4NO+3O2+2H2O=4HNO3和4NO2+O2+2H2O=4HNO3,设试管体积为vL,由反应可知,全部为NO、O2时,得到试管内硝酸浓度最小,最小为: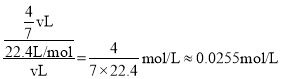 ;全部为NO2、O2时,得到试管内硝酸浓度最大,最大为:
;全部为NO2、O2时,得到试管内硝酸浓度最大,最大为: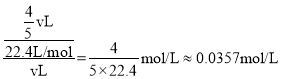 ,反应试管内的溶液的物质的量浓度范围是0.0357>c(HNO3)>0.0255或
,反应试管内的溶液的物质的量浓度范围是0.0357>c(HNO3)>0.0255或![]() >c(HNO3)>
>c(HNO3)>![]() ,故答案为:0.0357>c(HNO3)>0.0255或
,故答案为:0.0357>c(HNO3)>0.0255或![]() >c(HNO3)>
>c(HNO3)>![]() 。
。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案