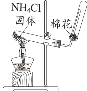
题目内容
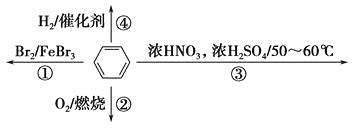
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,X、Y、Z三种元素的原子序数之和为25,且Z和X的原子序数之和比Y的原子序数的2倍还多1,X原子核外有2个电子层,最外层电子数是核外电子数的2/3;W在所在周期中原子半径最小。回答下列问题:
(1)W在元素周期表中的位置是________________
(2)X的原子结构示意图是___________。
(3)用电子式表示Z2Y的形成过程:____________________。
(4)在Z2XY3溶液中加入足量MgCl2溶液,过滤沉淀,取滤液,再滴加CaCl2溶液,溶液仍然出现白色沉淀,说明Z2XY3与MgCl2的反应存在___________,该反应的离子方程式为__________。
(5)以X的简单氢化物、Y的单质为两电极原料,Z2Y溶于水形成的溶液为电解质溶液,可制备燃料电池。该燃料电池的负极反应为___________________。
【答案】第三周期第ⅦA族 ![]()
![]() 一定限度 CO32-+Mg2+MgCO3↓ CH4-8e-+10OH-=CO32-+7H2O
一定限度 CO32-+Mg2+MgCO3↓ CH4-8e-+10OH-=CO32-+7H2O
【解析】
X原子有2个电子层,最外层电子数是核外电子数的![]() 倍,设最外层电子数为a,则
倍,设最外层电子数为a,则![]() (2+a)=a,解得a=4,故X为C元素;则Z、Y原子质子数之和为25-6=19,设Z原子的质子数为x,Y原子的质子数为y,则x+y=19,而Z与X的原子序数之和比Y的原子序数的2倍还多1,则6+x=2y+1,联立方程解得y=8,x=11,即Y为O元素,Z为Na,W在所在周期中原子半径最小,W为Cl。
(2+a)=a,解得a=4,故X为C元素;则Z、Y原子质子数之和为25-6=19,设Z原子的质子数为x,Y原子的质子数为y,则x+y=19,而Z与X的原子序数之和比Y的原子序数的2倍还多1,则6+x=2y+1,联立方程解得y=8,x=11,即Y为O元素,Z为Na,W在所在周期中原子半径最小,W为Cl。
(1)W为Cl,在元素周期表中的位置是第三周期第ⅦA族,故答案为:第三周期第ⅦA族;
(2)X为C元素,是6号元素,原子结构示意图是![]() 。故答案为:
。故答案为:![]() ;
;
(3)Na2O是离子化合物,氧得2个电子,用电子式表示Na2O的形成过程:![]() 。故答案为:
。故答案为:![]() ;
;
(4)在Na2CO3溶液中加入足量MgCl2溶液,过滤沉淀,取滤液,再滴加CaCl2溶液,溶液仍然出现白色沉淀,说明溶液中仍然含有碳酸根离子,得出Na2CO3与MgCl2的反应存在一定限度,该反应是可逆反应,离子方程式为CO32-+Mg2+MgCO3↓。故答案为:一定限度;CO32-+Mg2+MgCO3↓;
(5)以C的简单氢化物CH4、O2为两电极原料,Na2O溶于水形成的NaOH溶液为电解质溶液,可制备燃料电池。负极上甲烷失电子,被氧化生成的二氧化碳溶于NaOH生成碳酸钠,该燃料电池的负极反应为CH4-8e-+10OH-=CO32-+7H2O。故答案为:CH4-8e-+10OH-=CO32-+7H2O。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】(1)某学生为了探究锌与盐酸反应过程中的速率变化,在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 120 | 232 | 290 | 310 |
①上述实验过程中,反应速率最大时间段是________(选填字母作答),该时间段反应速率最大的主要原因是________________________________________________________。
A.0~1min B.1~2min C.2~3min D.3~4min E.4~5min
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率___________________(假设反应过程中溶液体积不变)。
(2)某温度下在容积为1L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是______________________________________________。
②该反应达到平衡状态的标志是________。
A.X的浓度不再改变
B.Y的体积分数在混合气体中保持不变
C.容器内气体的总压强保持不变
D.容器内气体的总质量保持不变
③反应进行到2min时,Y的转化率为_____________。
(3)燃料电池可以将气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式。但传统燃料电池使用氢气为燃料,而氢气既不易制取又难以储存,导致燃料电池成本居高不下。科研人员尝试用便宜的甲烷、乙烷等碳氢化合物为燃料,设计出新型燃料电池,使其成本大大低于以氢气为燃料的传统燃料电池。请写出以甲烷为燃料、硫酸为电解质溶液的该新型燃料电池工作时负极的电极反应方程式_________。
【题目】CO2的捕捉、封存与再利用是实现温室气体减排的重要途径之一。请回答:
(1)二氧化碳的电子式为__________。
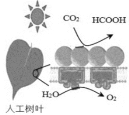
(2)一种正在开发的利用二氧化碳制取甲酸(HCOOH)的途径如图所示,图中能量主要转化方式为_____________ ,CO2和H2O转化为甲酸的化学方程式为____________。
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
①恒容容器中,能加快该反应速率的是_______。
a.升高温度 b.从体系中分离出CH3OH c.加入高效催化剂 d.降低压强
②在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如图所示。从反应开始到5min末,用H2浓度变化表示的平均反应速率________________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
③在相同温度、恒容的条件下,能说明该反应已达平衡状态的是_______(填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再改变化
b.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
c.容器中混合气体的密度不变
d.v消耗(H2)=3v消耗(CH3OH)
e.体系压强不变
(4)下列一些共价键的键能如下表所示:
化学键 | H-H | H-O | C=O | C-H | C-O |
键能kJ/mol | 436 | 463 | 803 | 414 | 326 |
反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),______(填“吸收”或“放出”) 的热量为_____kJ
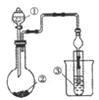
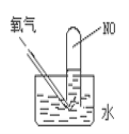
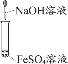
【题目】利用图示装置进行实验,不能得出相应结论的是( )
溶液① | 固体② | 溶液③ | 实验结论 |
| |
A | 稀硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 | |
D | 浓氨水 | CaO | AlCl3 | 可以制备Al(OH)3 |
A. A B. B C. C D. D