��Ŀ����
����Ŀ���������Ϣ��գ�
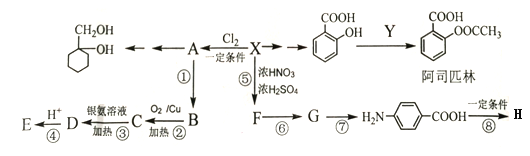
(1)FeCl3��Һ�����ڸ�ʴӡˢ��·ͭ�壬������Ӧ2FeCl3 +Cu ===2FeCl2 +CuCl2�������˷�Ӧ��Ƴ�ԭ��أ������õĵ缫����Ϊ____������·��ת��0.2mol����ʱ����ʴ��ͭ������Ϊ____��
(2)��ͼ��ʾ�����Թܷ���ʢ��25��ı��ͳ���ʯ��ˮ���ձ��У��Թ��п�ʼ���뼸С��þƬ�����õιܵ���5 mL�������Թ��У��ɹ۲쵽��Һ����ǣ��Իش��������⣺

�ٲ������������ԭ����___________________________��
��д���йط�Ӧ�����ӷ���ʽ___________________��
����ʵ����֪��MgCl2��H2��������__________(����ڡ�����С�ڡ����ڡ�)Mg��HCl����������
���𰸡�Cu 6.4 þƬ��ϡ���ᷴӦΪ���ȷ�Ӧ���������Ƶ��ܽ�����¶����߶���С���Ӷ����� Mg +2H+ =Mg2+ +H2�� С��
��������
(1)�õ�ط�Ӧ�У�ͭʧ���ӷ���������Ӧ�����������������������ӵõ��ӷ�����ԭ��Ӧ����Fe2+����ϵ����غ���м��㣻
(2)��þ�����ᷴӦ�Ƿ��ȷ�Ӧ���������Ƶ��ܽ�����¶����߶���С��
��þ�����ᷴӦ�������Ȼ�þ��������
�۷��ȷ�Ӧ��ָ��Ӧ������������������������
(1)�õ�ط�Ӧ�У�ͭʧ���ӷ���������Ӧ��������������ӦʽΪCu-2e-=Cu2+�����������������ӵõ��ӷ�����ԭ��Ӧ���缫��ӦΪ��2Fe3++2e-=2Fe2+������·��ת��0.2mol����ʱ����Ӧ��CuΪ0.1mol��������Ϊ0.1mol��64g/mol=6.4g��
(2)��þ��������ҷ�Ӧ�������������ų��������ȣ������������Ƶ��ܽ�����¶����߶���С�����Ա���ʯ��ˮ���º���������������ʹ��Һ�ʻ���״��
��þ�����ᷢ���û���Ӧ�������Ȼ�þ����������Ӧ�����ӷ���ʽΪMg +2H+ =Mg2+ +H2����
�۵���Ӧ����������������������ʱ����Ӧ�Ƿ��ȷ�Ӧ����MgCl2��Һ��H2��������С��þƬ���������������