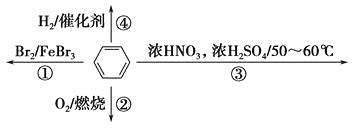
题目内容
【题目】下图是元素周期表的一部分,A—I九种元素在元素周期表中的位置如图:

请回答下列问题:
(1)B在周期表中的位置_______;E的离子结构示意图______。
(2)C的最高价氧化物对应的水化物与C的气态氢化物发生反应,生成物中含有的化学键类型是_____。
(3)G、I的最高价氧化物对应的水化物的化学式是_________、_____。
(4)A、D形成的化合物中只含极性键的物质的电子式为______。
(5)F、H的简单离子半径较大的是______(用离子符号表示),H、I的气态氢化物稳定性较强的是____(填化学式)。
【答案】第二周期ⅣA族 ![]() 离子键、共价键 Al(OH)3 HClO4
离子键、共价键 Al(OH)3 HClO4 ![]() S2- HCl
S2- HCl
【解析】
由元素在周期表中位置,可知A为H、B为C、C为N、D为O、E为Na、F为Mg、G为Al、H为S、I为Cl,根据元素周期律进行分析判断。
由元素在周期表中位置,可知A为H、B为C、C为N、D为O、E为Na、F为Mg、G为Al、H为S、I为Cl。
(1)B为C元素,在元素周期表中第二周期ⅣA族;E为Na元素,Na+离子结构示意图为![]() ;
;
(2)C为N元素,其最高价氧化物对应的水化物HNO3与C的气态氢化物NH3发生反应,生成物NH4NO3中铵根离子与硝酸根离子之间形成离子键,铵根离子中氮原子与氢原子之间、硝酸根离子中氮原子与氧原子之间形成共价键,故NH4NO3中含有的化学键类型是离子键、共价键;
(3)G、I分别为Al元素和Cl元素,它们的最高价氧化物对应的水化物的化学式分别是Al(OH)3、HClO4;
(4)A、D形成的化合物中只含极性键的物质H2O的电子式为![]() ;
;
(5)F、H的简单离子Mg2+、S2-,后者多一个电子层,离子半径较大的是S2-,非金属性越强,气态氢化物的稳定性越强,故H、I的气态氢化物H2S、HCl的稳定性较强的是HCl。

【题目】(1)某学生为了探究锌与盐酸反应过程中的速率变化,在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 120 | 232 | 290 | 310 |
①上述实验过程中,反应速率最大时间段是________(选填字母作答),该时间段反应速率最大的主要原因是________________________________________________________。
A.0~1min B.1~2min C.2~3min D.3~4min E.4~5min
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率___________________(假设反应过程中溶液体积不变)。
(2)某温度下在容积为1L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是______________________________________________。
②该反应达到平衡状态的标志是________。
A.X的浓度不再改变
B.Y的体积分数在混合气体中保持不变
C.容器内气体的总压强保持不变
D.容器内气体的总质量保持不变
③反应进行到2min时,Y的转化率为_____________。
(3)燃料电池可以将气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式。但传统燃料电池使用氢气为燃料,而氢气既不易制取又难以储存,导致燃料电池成本居高不下。科研人员尝试用便宜的甲烷、乙烷等碳氢化合物为燃料,设计出新型燃料电池,使其成本大大低于以氢气为燃料的传统燃料电池。请写出以甲烷为燃料、硫酸为电解质溶液的该新型燃料电池工作时负极的电极反应方程式_________。