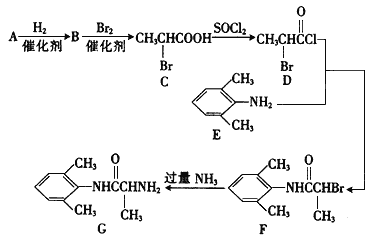
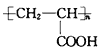题目内容
【题目】A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:
(1)分别写出三只烧杯中形成分散系的名称:
A________,B________,C________。
(2)写出C中形成分散系的化学方程式:_____________________________________。
(3)若不用化学试剂鉴别,写出鉴别B、C分散系的两种简单方法:
①______________________________________________________,
②________________________________________________________。
(4)向C中逐滴加入稀H2SO4,现象为________________________________。
【答案】 悬浊液 溶液 胶体 FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 观察颜色,红色的液体为B,红褐色的液体为C 用一束光照射两液体,有光亮通路的液体为C,另一液体为B 先生成红褐色沉淀,然后沉淀逐渐溶解至沉淀消失形成棕黄色溶液
Fe(OH)3(胶体)+3HCl 观察颜色,红色的液体为B,红褐色的液体为C 用一束光照射两液体,有光亮通路的液体为C,另一液体为B 先生成红褐色沉淀,然后沉淀逐渐溶解至沉淀消失形成棕黄色溶液
【解析】(1)氢氧化钠溶液中滴入FeCl3溶液发生复分解反应,生成氢氧化铁红褐色沉淀;分散系是悬浊液;KSCN溶液中滴入FeCl3溶液会生成血红色溶液硫氰酸铁络合物,分散系是溶液;煮沸的蒸馏水滴入FeCl3溶液加热到呈红褐色,会生成氢氧化铁胶体,分散系是胶体;故答案为:悬浊液;溶液;胶体;(2)C中形成分散系是胶体,反应的化学方程式为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;(3) B、C分散系分别是溶液和胶体,鉴别B、C分散系的简单方法有:①观察颜色,红色的液体为B,红褐色的液体为C;②用一束光照射两液体,有光亮通路的液体为C,另一液体为B;(4)向C中逐滴加入稀H2SO4,先聚沉后溶解,故现象为:先生成红褐色沉淀,然后沉淀逐渐溶解至沉淀消失形成棕黄色溶液。
Fe(OH)3(胶体)+3HCl;(3) B、C分散系分别是溶液和胶体,鉴别B、C分散系的简单方法有:①观察颜色,红色的液体为B,红褐色的液体为C;②用一束光照射两液体,有光亮通路的液体为C,另一液体为B;(4)向C中逐滴加入稀H2SO4,先聚沉后溶解,故现象为:先生成红褐色沉淀,然后沉淀逐渐溶解至沉淀消失形成棕黄色溶液。

 阅读快车系列答案
阅读快车系列答案【题目】纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,其水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:________。
(2)实验室中用过氧化氢制取氧气的化学方程式为_______________,当生成标准状况下1.12 L O2时,转移电子为________ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:______________________。
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被________(填“氧化”或“还原”)。
②滴定到达终点的现象是______________________________________。
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为________mol·L-1。
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果____(填“偏低”、“偏高”或“不变”)。
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确_____________________。