题目内容
13.某有机物的结构简式如图,根据乙烯、乙酸、乙醇性质类比,该物质不应有的化学性质是( )①可燃烧 ②可跟溴水加成 ③可使酸性KMnO4溶液褪色④可跟NaHCO3溶液反应 ⑤可跟NaOH溶液反应⑥可在碱性条件下水解.
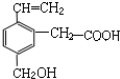
| A. | ①③ | B. | ③⑥ | C. | ④⑤ | D. | ⑥ |
分析 根据有机物结构特点,有碳碳双键决定具有烯的性质,有羧基决定具有羧酸的性质,有醇羟基决定具有醇的性质,有苯环还具有苯的性质.
解答 解:①是烃的含氧衍生物,具有可燃烧,故①正确;
②分子中含有碳碳双键,能与溴发生加成反应,故②正确;
③分子中含有碳碳双键,醇羟基等,能被酸性KMnO4氧化,使酸性KMnO4溶液褪色,故③正确;
④分子中有羧基,能与NaHCO3溶液反应,生成二氧化碳,故④正确;
⑤分子中有羧基,能与NaOH溶液发生酸碱中和反应,故⑤正确;
⑥该有机物不含能水解的基团,不能水解,故⑥错误.
故选:D
点评 本题考查有机物结构和性质,为高考高频点,明确物质中官能团与性质的关系是解本题关键,根据具有的官能团确定其性质,题目难度不大.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
3. (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”、“<”或“=”):SiC>Si;SiCl4<SiO2.
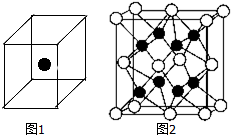
②如图1立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
③工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236kJ/mol.
(2)化合物Na2O的晶胞如图2.其中O2-离子的配位数为8.该化合物与MgO相比,熔点较高的是MgO.(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA).
 (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
①比较下列两组物质的熔点高低(填“>”、“<”或“=”):SiC>Si;SiCl4<SiO2.
②如图1立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
③工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236kJ/mol.
(2)化合物Na2O的晶胞如图2.其中O2-离子的配位数为8.该化合物与MgO相比,熔点较高的是MgO.(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA).
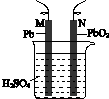
1.做焰色反应实验的铂丝应用( )
| A. | 硫酸洗涤 | B. | 稀盐酸洗涤 | C. | 水洗涤 | D. | 醋酸洗涤 |
5.关于给定的原电池的下列说法中,错误的是( )


| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由锌片流向铜片 | |
| D. | 该电池工作时,H+在锌片上得电子被还原生成H2逸出 |
2.下列说法正确的是( )
| A. | 可通过控制溶液的pH降低氨基酸的熔点,分离不同氨基酸 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| C. | 所有的糖类、油脂和蛋白质均能发生水解反应 | |
| D. | 利用二氧化碳制造全降解塑料能有效减少“白色污染” |
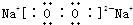

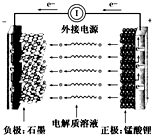 通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
通常氢氧燃料电池有酸式和碱式两种,试回答下列问题: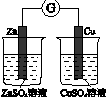
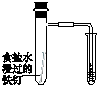
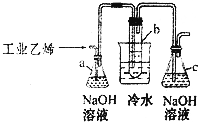 CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br
CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br