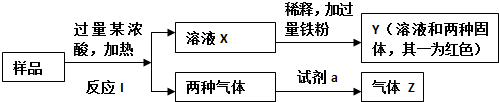
题目内容
8.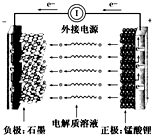 通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:(1)在酸式介质中,负极材料为石墨,正极材料为石墨,酸式电池的电极反应:负极:2H2-4e-=4H+,正极:O2+4e-+4H+=2H2O.电解质溶液PH的变化变大(填“变大”,“变小”,“不变”)
(2)在碱式介质中,碱式电池的电极反应:负极:2H2-4e-+4OH-=2H2O,正极:O2+4e-+2H2O=4OH-
电解质溶液PH的变化变小(填“变大”,“变小”,“不变”)
(3)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是C.
A.太阳光催化分解水制氢气比电解水气氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同
(4)纯电动车采用了高效耐用的一种新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.
①该电池放电时负极反应式为Zn-2e-+2OH-=Zn(OH)2.
②放电时每转移3mol电子,正极有1 mol K2FeO4被还原.
(5)锰酸锂离子电池在混合动力车等大型蓄电池应用领域占据主导地位.电池反应式为:Li1-xMnO4+Lix$?_{充电}^{放电}$LiMnO4,下列有关说法不 正确的是C.
A.放电时电池的正极反应式为:Li1-xMnO4+xLi++xe-═LiMnO4
B.放电过程中,石墨没有得失电子
C.该电池也能在KOH溶液的环境中正常工作
D.充电时电池上标有“-”的电极应与外接电源的负极相连.
分析 (1)在酸性氢氧燃料电池中电极本身不放电,氢气在负极失电子,被氧化,氧气在正极得电子,被还原;
(2)在碱式介质中,氢气失去电子生成氢离子,氢离子结合氢氧根离子生成水;
(3)A、太阳能催化分解水制氢气将太阳能直接转化为化学能;
B、氢氧燃料电池产物无污染;
C、以稀H2SO4、KOH为介质的氢氧燃料电池的负极在不同介质中反应式不同;
D、以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同;
(4)①放电时,负极上锌失电子发生氧化反应;
②放电时,正极上1molK2FeO4得3mol电子发生还原反应生成1molFe(OH)3;
(5)放电时的反应为Li1-xMnO4+Lix=LiMnO4,化合物中Li元素的化合价降低,单质L中i元素的化合价升高,结合原电池中负极发生氧化反应,正极发生还原反应来解答.
解答 解:(1)在酸性氢氧燃料电池中,石墨作电极,在负极由氢气失电子生成氢离子,电极反应为2H2-4e-=4H+;在正极由氧气得电子生成氢氧根离子,生成的氢氧根离子结合氢离子生成水,电极反应为O2+4e-+4H+=2H2O,由于正负极消耗与生成的氢离子等量,所以氢离子的总量不变,而总电极反应式为2H2+O22H2O,水的总量增加,故PH变大,
故答案为:石墨;石墨;2H2-4e-=4H+;O2+4e-+4H+=2H2O;变大;
(2)在碱式介质中,氢气在负极失去电子生成氢离子,氢离子结合氢氧根离子生成水,电极反应式为2H2-4e-+4OH-=2H2O;氧气在正极得电子生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-,由于正负极消耗与生成的氢氧根离子等量,所以氢氧根离子的总量不变,而总电极反应式为2H2+O2=2H2O,水的总量增加,故PH变小,
故答案为:2H2-4e-+4OH-=2H2O;O2+4e-+2H2O=4OH-;变小;
(3)A、电解获得H2消耗较多的能量,而在催化剂作用下利用太阳能来分解H2O获得H2更为科学,故A正确;
B、氢氧燃料电池产物H2O无污染,能有效保护环境,故B正确;
C、以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式分别为:H2-2e-═4H+,H2-2e-+2OH-=2H2O,不相同,故C错误;
D、以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式均为2H2+O2=2H2O,故D正确.
故选C;
(4)①放电时,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-+2OH-═Zn(OH)2,故答案为:Zn-2e-+2OH-═Zn(OH)2;
②放电时,正极上1molK2FeO4得3mol电子发生还原反应生成1molFe(OH)3,所以每转移3 mol电子,正极有1molK2FeO4被还原,故答案为:1;
(5)A、根据总反应式可知Li失去电子,电池负极反应式为:xLi-xe-═xLi+,由总反应式减去负极反应式可得放电时的正极反应式为Li1-xMnO4+xLi++xe-═LiMnO4,故A正确;
B、放电过程中,根据总反应式Li1-xMnO4+Lix$?_{充电}^{放电}$LiMnO4,可判断石墨没有电子得失,故B正确;
C、Li能与KOH溶液中的H2O反应,导致电池无法正常工作,故C错误;
D、充电过程是放电的逆向过程,外界电源的负极提供的电子使原电池负极获得电子发生还原反应,所以标有“-”的电极应与外接电源的负极相连,故D正确.
故答案为:C.
点评 本题考查电解池与原电池,需要明确电极反应中放电为原电池,而充电为电解池,氢氧燃料电池的负极在不同介质中反应式不同,题目难度较大.

| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能肯定 |
| A. | Na与FeCl2溶液常温混合 | B. | CO通过灼热的Fe2O3 | ||
| C. | H2通入FeSO4溶液 | D. | Al和Fe3O4混合加热至高温 |
①可燃烧 ②可跟溴水加成 ③可使酸性KMnO4溶液褪色④可跟NaHCO3溶液反应 ⑤可跟NaOH溶液反应⑥可在碱性条件下水解.
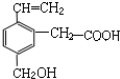
| A. | ①③ | B. | ③⑥ | C. | ④⑤ | D. | ⑥ |
| A. | CO2 | B. | N2 | C. | SO2 | D. | CC12F2 |
| A. | 将颗粒状锶单质放入水中,反应剧烈,生成大量的气体,气体燃烧且发生轻微爆炸 | |
| B. | 颗粒状锶单质与稀硫酸反应,反应现象不如钠与水反应剧烈 | |
| C. | 锶在纯氧中可以燃烧,燃烧产物与水反应生成的氢氧化物为强碱 | |
| D. | 锶在纯净氮气中可以燃烧,燃烧产物与水反应可以放出气体 |
| A. | Na、Ca、Mg、Al、K | B. | Na、K、Zn、Fe、Hg | C. | Zn、Fe、Cu、Ag、Sn | D. | Mg、Al、Zn、Fe、Pb |
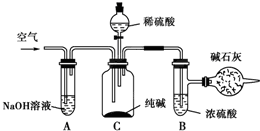 工业纯碱中常含有NaCl、Na2SO4等杂质,可用如下图所示的装置测定工业纯碱中有效成分的含量.实验过程的主要步骤是:
工业纯碱中常含有NaCl、Na2SO4等杂质,可用如下图所示的装置测定工业纯碱中有效成分的含量.实验过程的主要步骤是: