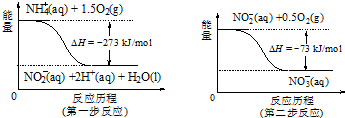
题目内容
2.下列说法正确的是( )| A. | 可通过控制溶液的pH降低氨基酸的熔点,分离不同氨基酸 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| C. | 所有的糖类、油脂和蛋白质均能发生水解反应 | |
| D. | 利用二氧化碳制造全降解塑料能有效减少“白色污染” |
分析 A、控制溶液pH,可生成不同的氨基酸晶体,过滤可达到分离的目的;
B、聚乙烯中不含有碳碳双键;
C、单糖不能水解;
D、利用二氧化碳制造全降解塑料,减少了塑料的使用.
解答 解:A、不同的氨基酸在水溶液中形成晶体析出时pH各不相同,控制溶液pH,可生成不同的氨基酸晶体,过滤可达到分离的目的,不是通过pH值降低氨基酸的熔点,故A错误;
B、聚乙烯是乙烯加聚反应生成的产物,结构中不含有碳碳双键,不能使高锰酸钾溶液褪色,故B错误;
C、单糖中的葡萄糖和果糖均不能发生水解反应,故C错误;
D、利用二氧化碳制造全降解塑能减少二氧化碳的排放,能有效减少环境污染,故D正确,故选D.
点评 本题考查化学与社会、环境的关系,把握能源使用及污染物的排放为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.某有机物的结构简式如图,根据乙烯、乙酸、乙醇性质类比,该物质不应有的化学性质是( )
①可燃烧 ②可跟溴水加成 ③可使酸性KMnO4溶液褪色④可跟NaHCO3溶液反应 ⑤可跟NaOH溶液反应⑥可在碱性条件下水解.
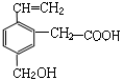
①可燃烧 ②可跟溴水加成 ③可使酸性KMnO4溶液褪色④可跟NaHCO3溶液反应 ⑤可跟NaOH溶液反应⑥可在碱性条件下水解.

| A. | ①③ | B. | ③⑥ | C. | ④⑤ | D. | ⑥ |
10.根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物[ | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同 | |
| B. | 反应①中,当只有少量Cl2时,反应可表示为Cl2+Fe2+═Fe3++2Cl- | |
| C. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| D. | 表中③组反应的离子方程式为2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
17.已知元素周期表中第ⅡA族元素有铍、镁、钙、锶、钡、镭,钙与水反应较剧烈,下列关于锶单质的性质描述错误的是( )
| A. | 将颗粒状锶单质放入水中,反应剧烈,生成大量的气体,气体燃烧且发生轻微爆炸 | |
| B. | 颗粒状锶单质与稀硫酸反应,反应现象不如钠与水反应剧烈 | |
| C. | 锶在纯氧中可以燃烧,燃烧产物与水反应生成的氢氧化物为强碱 | |
| D. | 锶在纯净氮气中可以燃烧,燃烧产物与水反应可以放出气体 |
7.下列化学实验事实及其解释都正确的是( )
| A. | 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,该现象说明可用CCl4从碘水中萃取碘. | |
| B. | 向某水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明原溶液中一定含有SO42-离子 | |
| C. | 将饱和氯化铁溶液煮沸,可制得氢氧化铁胶体 | |
| D. | 稀释浓硫酸时将浓硫酸沿烧杯壁慢慢注入水中并不断搅拌 |
11.元素X与Y结合,分别形成分子式XY、XY2、X3Y4的三种化合物,在与固定质量的Y元素的化合反应中,X的各质量的简单比为( )
| A. | 1:2:4 | B. | 2:1:3 | C. | 3:4:2 | D. | 4:2:3 |