题目内容
3.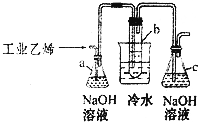 CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br
CH2Br-CH2Br可作汽油抗爆剂的添加剂,常温下是无色液体,温度2.18g•cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.试管b中装有液溴(表面覆盖少量水).工业用乙烯中含少量H2S气体.利用工业乙烯通过下列装置可制备少量CH2B-CH2Br(1)容器a中NaOH溶液的作用是除去乙烯中带出的酸性气体
(2)写出本题中制备CH2Br-CH2Br的化学方程式CH2=CH2+Br2→CH2BrCH2Br,该反应属于加成反应(填反应类型)
(3)解释将试管b放入盛有冷水的烧杯中的理由:使溴乙烷转化为固体
(4)某学生在做实验时,使用一定量的液溴.当溴全部褪色时,所消耗工业乙烯的量比正常情况下超出许多.试分析其可能的原因乙烯发生(或通过液溴)速度过快.
分析 (1)乙烯中含有少量硫化氢,硫化氢能够与溴发生反应,所以应用氢氧化钠除去;
(2)乙烯与溴加成生CH2Br-CH2Br;
(3)CH2Br-CH2Br熔点低,用冷水冷却使其转化为固体;
(4)根据乙烯与溴反应的利用率减少的可能原因进行解答.
解答 解:(1)乙烯中含有少量硫化氢,硫化氢能够与溴发生反应,所以应用氢氧化钠除去,所以氢氧化钠溶液的作用为:除去乙烯中带出的酸性气体;
故答案为:除去乙烯中带出的酸性气体;
(2)乙烯与溴加成生CH2Br-CH2Br,化学方程式:CH2=CH2+Br2→CH2BrCH2Br;属于加成反应;
故答案为:CH2=CH2+Br2→CH2BrCH2Br;加成反应;
(3)CH2Br-CH2Br熔点低,用冷水冷却使其转化为固体;
故答案为:使溴乙烷转化为固体;
(4)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多的原因可能是乙烯发生(或通过液溴)速度过快,导致大部分乙烯没有和溴发生反应,
故答案为:乙烯发生(或通过液溴)速度过快.
点评 本题考查了溴乙烷的制取方法,题目难度中等,注意掌握溴乙烷的制取原理、反应装置选择及除杂、提纯方法即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.某有机物的结构简式如图,根据乙烯、乙酸、乙醇性质类比,该物质不应有的化学性质是( )
①可燃烧 ②可跟溴水加成 ③可使酸性KMnO4溶液褪色④可跟NaHCO3溶液反应 ⑤可跟NaOH溶液反应⑥可在碱性条件下水解.
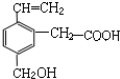
①可燃烧 ②可跟溴水加成 ③可使酸性KMnO4溶液褪色④可跟NaHCO3溶液反应 ⑤可跟NaOH溶液反应⑥可在碱性条件下水解.

| A. | ①③ | B. | ③⑥ | C. | ④⑤ | D. | ⑥ |
11.元素X与Y结合,分别形成分子式XY、XY2、X3Y4的三种化合物,在与固定质量的Y元素的化合反应中,X的各质量的简单比为( )
| A. | 1:2:4 | B. | 2:1:3 | C. | 3:4:2 | D. | 4:2:3 |
18.下列金属的冶炼,均不能用热还原法制得一组是( )
| A. | Na、Ca、Mg、Al、K | B. | Na、K、Zn、Fe、Hg | C. | Zn、Fe、Cu、Ag、Sn | D. | Mg、Al、Zn、Fe、Pb |
8.设NA为阿伏伽德罗常数,数值约为6.02×1023,下列说法不正确的是( )
| A. | 32g S8单质中含有的S-S键个数为6.02×1023 | |
| B. | 12.4g白磷中含有磷原子数为0.4NA | |
| C. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| D. | 0.1mol OH-含NA个电子 |
15.下列说法正确的是( )
| A. | BaSO4在医学上用作钡餐,Ba2+ 对人体无毒 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 分子间作用力比化学键弱的多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响 | |
| D. | ${\;}_{\;}^{14}$C可用于文物鉴定,${\;}_{\;}^{12}$C与${\;}_{\;}^{12}$C互为同素异形体 |
 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.
在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.