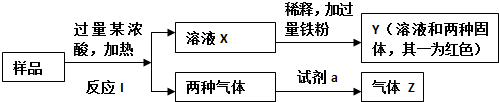
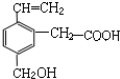
题目内容
4.按要求回答下列问题(1)Na2O2的电子式
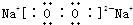
(2)HCN的结构式H-C≡N
(3)用电子式表示 HCl的形成过程

(4)已知在周期表中处于对角线位置的元素(如铍与铝)具有某些相似的性质,试写出氢氧化铍与NaOH反应的化学方程式Be(OH)2+2NaOH═Na2BeO2+2H2O.
分析 (1)Na2O2中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键;
(2)HCN中C能形成四对共价键,N能形成三对共价键;
(3)HCl属于共价化合物,氢原子最外层电子与Cl最外层电子形成一对共用电子对;
(4)依据对角线规则,氢氧化铍性质与氢氧化铝性质相似,结合原子个数守恒配平解答.
解答 解:(1)Na2O2中钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,电子式为: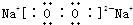 ,故答案为:
,故答案为: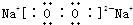 ;
;
(2)HCN中C能形成四对共价键,N能形成三对共价键,故结构式为:H-C≡N,故答案为:H-C≡N;
(3)HCl属于共价化合物,氢原子最外层电子与Cl最外层电子形成一对共用电子对,其形成过程可写为: ,
,
故答案为: ;
;
(4)依据对角线规则,氢氧化铍性质与氢氧化铝性质,氢氧化铝与强碱反应生成偏铝酸钠,所以氢氧化铍与氢氧化钠反应的化学方程式为:Be(OH)2+2NaOH═Na2BeO2+2H2O,故答案为:Be(OH)2+2NaOH═Na2BeO2+2H2O.
点评 本题主要考查电子式书写,结构式判断等,难度不大,应判断化学式中,原子间的化学键类型,再用电子式写出其形成过程.

练习册系列答案
相关题目
14. 已知某气态团簇分子由X、Y、Z三种元素组成,其分子晶胞如图所示,则下面表示该化合物的分子式正确的是( )
已知某气态团簇分子由X、Y、Z三种元素组成,其分子晶胞如图所示,则下面表示该化合物的分子式正确的是( )
 已知某气态团簇分子由X、Y、Z三种元素组成,其分子晶胞如图所示,则下面表示该化合物的分子式正确的是( )
已知某气态团簇分子由X、Y、Z三种元素组成,其分子晶胞如图所示,则下面表示该化合物的分子式正确的是( )| A. | ZXY3 | B. | ZX2Y6 | C. | ZX4Y8 | D. | ZX8Y12 |
15.由相同条件下的三个反应:
2A-+B2═2B-+A2 2C-+A2═2A-+C22B-+D2═2D-+B2
判断下列说法正确的是( )
2A-+B2═2B-+A2 2C-+A2═2A-+C22B-+D2═2D-+B2
判断下列说法正确的是( )
| A. | 氧化性:A2>B2>C2>D2 | B. | 还原性:A->B->C->D- | ||
| C. | 2A-+D2═2D-+A2反应可以进行 | D. | 2C-+B2═2B-+C2反应不能进行 |
9.下列排序正确的是( )
| A. | 离子半径:Cl-<S2-<As3- | B. | 碱性:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 热稳定性:HCl<HBr<HI | D. | 沸点:AsH3<PH3<NH3 |
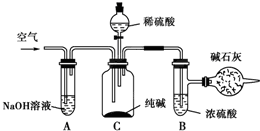 工业纯碱中常含有NaCl、Na2SO4等杂质,可用如下图所示的装置测定工业纯碱中有效成分的含量.实验过程的主要步骤是:
工业纯碱中常含有NaCl、Na2SO4等杂质,可用如下图所示的装置测定工业纯碱中有效成分的含量.实验过程的主要步骤是: