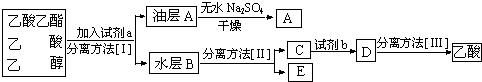
题目内容
6.100mL浓度为2mol•L-1的硫酸跟过量的锌片反应,某同学想加快反应速率,又不影响成氢气的总量,下列操作不符合要求的是( )| A. | 将锌片换成等量的锌粉 | B. | 加入数滴氯化铜溶液 | ||
| C. | 升高温度 | D. | 加入适量的6mol•L-1的硫酸 |
分析 增大反应物浓度、升高温度、增大压强(仅限于有气体参与的化学反应)、加入催化剂等加快反应速率,但不影响生成氢气的总量,说明最终酸电离出的氢离子物质的量不变.
解答 解:A.将锌片换成等量的锌粉,固体表面积增大,反应速率增大,生成氢气的量不变,故A不选;
B.加入数滴氯化铜溶液,锌置换出铜,形成原电池反应,反应速率增大,生成氢气的量不变,故B不选;
C.升高温度,反应速率增大,由于硫酸的量不变,则生成氢气的量不变,故C不选;
D.加入适量的6mol•L-1的硫酸,氢离子总量增大,生成氢气的总量增多,故D选.
故选D.
点评 本题考查化学反应速率影响因素,外界条件只影响反应速率但物质性质决定反应速率,知道反应速率的影响有哪些,题目难度不大.

练习册系列答案
相关题目
16.当酸碱完全中和时( )
| A. | 酸和碱的物质的量一定相等 | |
| B. | 酸能够提供的H+与碱所能提供的OHˉ的物质的量相等 | |
| C. | 酸与碱的质量相等 | |
| D. | 溶液呈中性 |
17.经X射线研究证明:PCl5在固体状态时,由空间构型分别为正四面体和正八面体两种离子构成.下列关于PCl5的推断正确的是( )
| A. | PCl5固体是分子晶体 | |
| B. | PCl5固体有良好的导电性 | |
| C. | PCl5晶体由[PCl4]+和[PCl6]-构成,其离子数目之比为1:1 | |
| D. | PCl5晶体由[PCl3]2+和[PCl7]2-构成,其离子数目之比为1:1 |
14.在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )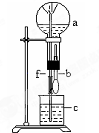

| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | NaHCO3溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | 1mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
1.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 14g乙烯和丙烯的混合气体中含有H原子数为2NA | |
| B. | 标准状况下2.24L乙醇与足量Na反应生成H2分子数0.05NA | |
| C. | 每摩尔-CH3中含10NA个电子 | |
| D. | 每摩尔甲苯中含有的碳碳单键的数目为7 NA |
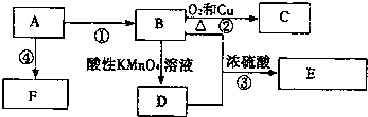
 ,F的结构简式
,F的结构简式 .
.